
��ѧ����Դ����������������ʮ�ֹؼ������á�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ�
I������ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������������ȼ�ϵ�ؽ�����ͼʵ�飨ͼ�����õ缫��Ϊ���Ե缫����
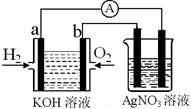
��1����������ȼ�ϵ���У����б��ﲻ��ȷ����________
A��a�缫�Ǹ�����OH������
B��b�缫�ĵ缫��ӦΪ��O2��2H2O��4e����4OH��
C������ܷ�ӦʽΪ��2H2+O2 2H2O
2H2O
D���������Һ��pH���ֲ���
E������ȼ�ϵ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
��2����ͼװ����ʢ��100mL��0.1mol��L��1AgNO3��Һ��������ȼ�ϵ������������112mL����״���£�ʱ�����ʱ��ͼװ������Һ��pH��________ ����Һ����仯���Բ��ƣ�
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ��������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�| 1 |
| 2 |
| 1 |
| 2 |
| ���ʵ���/��mol��/ʱ�䣨h�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
��ѧ����Դ����������������ʮ�ֹؼ������ã�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�
| ||
ʱ�䣨h�� ���ʵ�����mol�� |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʱ��/min | CO | H2O��g�� | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ���ȼ�ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�������а�У�߶���ѧ����ĩ������ѧ���� ���ͣ�ʵ����
��18�֣���ѧ����Դ��������������ʮ�ֹؼ������á�������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ�
�� ��1����298K��101kPaʱ��2g H2��ȫȼ������Һ̬ˮ���ų�285.8kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ�� ��
����ȼ�ϵ������ת���ʸߣ����й����ķ�չǰ������������ȼ�ϵ�ؽ�����ͼ����ʳ��ˮ���ʵ�飨ͼ�����õ缫��Ϊ���Ե缫����������װ�á��ش��������⣺
��2������ȼ�ϵ���У�a�缫Ϊ��ص��� �����������������������M�ķ���ʽ ��a�缫�Ϸ����ĵ缫��ӦʽΪ�� ��
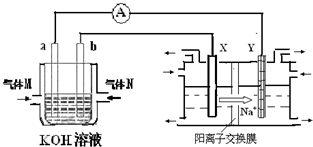
��3��������ͼװ����ʢ��100mL5.0mol/LNaCl��Һ�����һ��ʱ��������10.0mol/L������Һ50mL(�ܶ�Ϊ1.02g/mL)����ʹ��Һ�ָ���ԭ��״̬�����ڴ˵������е�����ת�Ƶĵ�����Ϊ mol��������С�����2λ��
�� �����Ǻϳɰ�����Ҫԭ�ϡ���ҵ�Ϻϳɰ��ķ�Ӧ�ǣ�
N2��g����3H2(g) 2NH3 (g) ��H����92.2kJ��mol��1
2NH3 (g) ��H����92.2kJ��mol��1
(4)������ʵ�У�����˵���������淴Ӧ�Ѿ��ﵽƽ����� ��
�� N2��H2��NH3������������ٸı䣻
�� ��λʱ��������2n mol NH3��ͬʱ����3n mol H2��
�� ��λʱ��������3n mol N��H����ͬʱ����n mol N��N��
�� ��N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2��
�� ��������ƽ��Ħ���������ٸı䣻
�� �������������ʵ������ٸı䡣
��5����֪�ϳɰ���Ӧ��ij�¶���2.00L���ܱ������з�Ӧ������������ݣ�
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2Сʱʱ�ų�������Ϊ kJ��
��0~1Сʱ��N2��ƽ����Ӧ���� mol��L-1��h-1��
�۴������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K== ��������λС������
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1 mol����ѧƽ���� �����ƶ��������Ӧ�����淴Ӧ�����ƶ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com