
| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
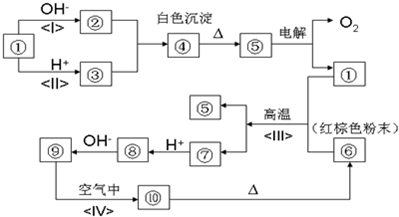
 常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,其密度为3.17g/L(标准状况下),B、C、D都是含A元素的化合物,转化关系如图所示

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2008?广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3?H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
(2008?广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率的变化可以确定滴定反应的终点.如图所示是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线.下列示意图中,能正确表示用NH3?H2O滴定HCl和CH3COOH混合溶液的滴定曲线的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:| [N2O4] |
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
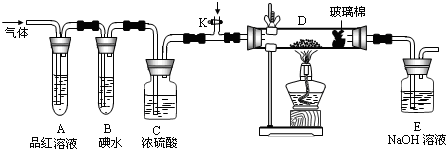
查看答案和解析>>
科目:高中化学 来源: 题型:
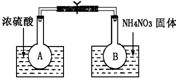 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com