
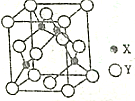
 已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:
已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:分析 X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,则X为N元素,M为NH4NO3,元素X的原子序数比常见元素Y的小,Y元素的周期序数等于最外层电子数,则Y为Al.
(1)在基态X原子核外核外电子排布为1s22s22p3,M为NH4NO3,其中阳离子为NH4+,计算N原子孤电子对、价层电子对数,进而确定立体构型与N原子的杂化类型;
(2)A晶体晶胞中N原子数目为4,Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故A为AlN,工业上用氮气与氧化铝和碳在一定条件下反应生成AlN和CO;
(3)已知BN的晶体类型与AlN晶体的相同,它们都是原子晶体,硼原子半径比铝原子半径小,所以B-N键能比较Al-N键能大,所以BN的熔点比AlN高;
(4)同周期自左而右元素电负性增大;N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(5)晶胞中Al、N原子数目均为4,则晶胞质量为4×$\frac{27+14}{{N}_{A}}$g,再根据V=$\frac{m}{ρ}$计算晶胞体积,晶体的棱长a=$\root{3}{V}$.
解答 解:X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,则X为N元素,M为NH4NO3,元素X的原子序数比常见元素Y的小,Y元素的周期序数等于最外层电子数,则Y为Al.
(1)在基态X原子核外核外电子排布为1s22s22p3,1s、2s轨道电子为自旋相反的电子对,即核外存在2对自旋相反的电子;
M为NH4NO3,其中阳离子为NH4+,N原子孤电子对=$\frac{5-1-1×4}{2}$=0、价层电子对数=4+0=4,故立体构型为正四面体,N原子采取sp3杂化,
故答案为:2;正四面体;sp3;
(2)A晶体晶胞中N原子数目为4,Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故A为AlN,工业上用氮气与氧化铝和碳在一定条件下反应生成AlN和CO,反应方程式为:N2+Al2O3+3C$\frac{\underline{\;一定条件\;}}{\;}$2AlN+3CO,
故答案为:N2+Al2O3+3C$\frac{\underline{\;一定条件\;}}{\;}$2AlN+3CO;
(3)BN的晶体类型与AlN晶体的相同,它们都是原子晶体,硼原子半径比铝原子半径小,所以B-N键能比较Al-N键能大,所以BN的熔点比AlN高,
故答案为:BN与AlN都是原子晶体,硼原子半径比铝原子半径小,所以B-N键能比较Al-N键能大,所以BN的熔点比AlN高;
(4)同周期自左而右元素电负性增大,故电负性N<O;N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,
故答案为:小;大;
(5)晶胞中Al、N原子数目均为4,则晶胞质量为4×$\frac{27+14}{{N}_{A}}$g,晶体密度为ρg•cm-3,晶胞体积=4×$\frac{27+14}{{N}_{A}}$g÷ρg•cm-3=$\frac{4×41}{{N}_{A}}$cm3,则晶体的棱长a=$\root{3}{\frac{4×41}{{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{4×41}{{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型与杂化方式判断、晶体类型与熔沸点、电离能、电负性、晶胞计算等,注意理解同周期第一电离能异常情况,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe3++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | Na2SO4溶液与BaCl2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应4Al(s)+3O2(g)=2Al2O3 (s) 的△S>0 | |
| B. | 吸热反应都需要在加热条件下才能进行 | |
| C. | 同温同压下,H2 (g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知:①S(s)+O2(g)=SO2(g)△H=-a kJ•mol-1, ②S(g)+O2(g)=SO2(g)△H=-b kJ•mol-1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+(Fe3+):加KSCN溶液后过滤 | |
| B. | CO(H2):让气体通过赤热的氧化铜 | |
| C. | C2H4(C2H2):与H2加成 | |
| D. | Cl2(HCl):通过饱和氯化钠水溶液洗涤后收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 镁铝合金质量/g | HCl溶液体积/mL | 气体的体积/L |
| 甲 | 2.55 | 400 | 2.80 |
| 乙 | 3.85 | 400 | 3.36 |
| 丙 | 4.59 | 400 | 3.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数少 | |
| B. | 酸性:HXO4>HYO4 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com