
| A. | 第二周期中,最高价含氧酸酸性最强的是氟 | |
| B. | 碘的非金属性比氯弱 | |
| C. | VA族中原子半径最小的是氮 | |
| D. | 钠的金属性比锂强 |
分析 A.F元素没有最高价氧化物的水化物;
B.同一主族元素,元素的非金属性随着原子序数增大而减小;
C.同一主族元素,原子半径随着原子序数增大而增大;
D.同一主族元素,元素的金属性随着原子序数增大而增强.
解答 解:A.F是最活泼的非金属元素,F元素没有最高价氧化物的水化物,故A错误;
B.同一主族元素,元素的非金属性随着原子序数增大而减小,所以非金属性Cl>I,故B增强;
C.同一主族元素,原子半径随着原子序数增大而增大,所以氮族元素中原子半径N最小,故C正确;
D.同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性Na>Li,故D正确;
故选A.
点评 本题考查元素周期律,为高频考点,侧重考查学生分析判断能力,明确同一周期、同一主族元素原子结构、元素性质递变规律是解本题关键,注意反常现象,F、O元素没有最高价氧化物的水化物.


科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 | |
| D. | 吸热反应在常温条件下一定不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如:
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如: ,其中碳氧原子之间共价键是c(填序号):
,其中碳氧原子之间共价键是c(填序号):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
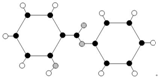
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
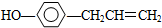 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与2mol溴发生反应 | |
| C. | 与FeCl3显紫色,因为该物质与苯酚属于同系物 | |
| D. | 胡椒酚在水中的溶解度大于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②⑤ | C. | ②③⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com