
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
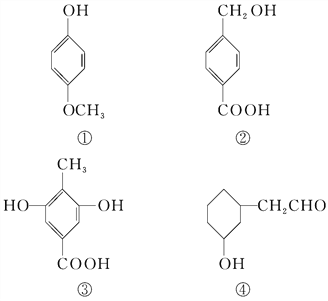
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol ③最多能与3 mol Br2发生反应
D.④属于醇类,可以发生消去反应
科目:高中化学 来源: 题型:
【题目】短周期p区元素多为非金属元素
(1)基态磷原子的价层电子排布图是__________,第三周期元素中,第一电离能最大的前三种元素是__________________。
(2)BF3、NF3、PCl3、SCl2四种分子中,属于平面三角形的是____________,中心原子杂化类型为sp3的是_______________。
(3)已知H2O的沸点比H2O2低58℃但比H2S高160℃,导致这种差异的原因是________________。
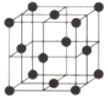
(4)金属铝的晶胞结构如图,若晶胞参数r pm,则单质的密度为(用NA表示阿伏加德罗常数)_______________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
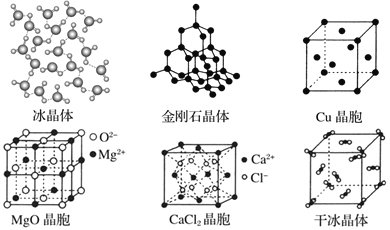
请回答下列问题:
(1)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____。
(2)MgO晶体中,距每个O2-最近且距离相等的O2-有_____个。
(3)每个Cu晶胞中实际占有_____个Cu原子;CaCl2晶体中Ca2+的配位数为_____。
(4)冰的熔点远高于干冰,除 H2O 是极性分子、CO2 是非极性分子外, 还有一个重要的原因是____。
(5)金刚石晶胞含有_________个碳原子;若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率_____(计算结果为含π的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe、MgB2、Nb3Al等超导材料具有广泛应用前景。
(1)Fe2+基态价电子的轨道表示式(价电子排布图)__,Se、Mg、B三种元素的电负性大小顺序是__。
(2)蒸气状态下以二聚分子存在的A1Cl3的结构式是___,其中A1原子的杂化方式是___,分子中八个原子___(选填“是”或“不是”)在同一平面上,该分子是____(选填“极性“或“非极性“)分子。
(3)制备FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2过程中需将金属锂溶于液氨,从而制得具有很高反应活性的金属电子溶液,反应为:Li+(m+n)NH3—X+e-(NH3)n。
①X的化学式为____;
②NH3的价层电子对互斥模型是 ____。
(4)MgB2晶体结构中的B原子层具有类似石墨的层状结构,且被六方密排的Mg原子层隔开,B原子位于Mg原子组成的三棱柱的中心。已知:平面中Mg原子间的最近核间距为acm,平面间Mg原子间的最近核间距为bcm,阿伏加德罗常数为NA。
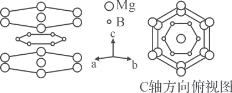
①B原子层六元环中处于对位的B原子核间距为____cm。
②MgB2晶体的密度是____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学反应的速率与时间的关系示意图。有关t1时刻改变条件的说法正确的是
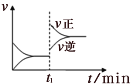
A.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0,t1时刻升高温度
CO(g)+H2(g) ΔH>0,t1时刻升高温度
B.H2O(g)+CO(g) ![]() H2(g)+CO2(g) ΔH>0,t1时刻增大压强
H2(g)+CO2(g) ΔH>0,t1时刻增大压强
C.2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,t1时刻升高温度
2SO3(g) ΔH<0,t1时刻升高温度
D.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2 浓度
4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2 浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
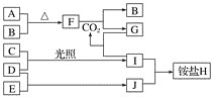
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子X的球棍模型(图中不同的小球分别代表C、H、O三种原子;球与球之间的短线代表化学键,如单键或双键等)。下列说法中正确的是()
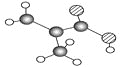
A.X属于羧酸,是乙酸的同系物
B.X可以发生加成反应和取代反应
C.与X含有相同官能团的结构还有1种
D.X分子中的4个碳原子,肯定不在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出铝丝与硫酸铜溶液的化学方程式,并用双线桥标出电子的转移。化学方程式: _______________;氧化剂:__________ ,还原剂: __________,氧化产物:___________ ,还原产物:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com