
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾加热制备氧气,用排水法收集满氧气后,先移出导管,后撤酒精灯 | |
| B. | 给试管加热时,先给试管来回均匀加热,后固定局部加热 | |
| C. | 大量碱液流到桌子上,先用醋酸溶液中和,后用抹布抹去 | |
| D. | 在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒蘸取溶液点在试纸中部,再与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓ 2NaHCO3═Na2CO3+CO2↑+H2O | |
| B. | 氢氧化钠:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH | |
| C. | 高温下制粗硅:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si | |
| D. | 电解法制金属镁:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶粒可以导电 | B. | 胶体是混合物 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
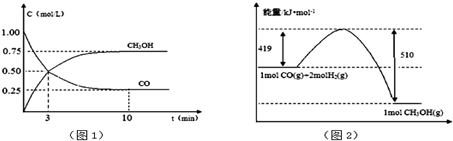
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体的物理性质不同,但化学性质相似 | |
| B. | 乙醇能与水以任意比互溶是因为乙醇和水之间可以形成氢键 | |
| C. | 石油催化重整的主要目的是为了获得烯烃 | |
| D. | 标准状况下,22.4LCHCl3中含氯原子数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com