
ij�о�С���о���������������ʱ���ı����������¿��淴Ӧ��Ӱ�죺
2SO2(g)��O2(g) 2SO3(g) +Q
2SO3(g) +Q
����˵����ȷ����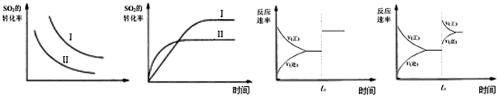
ͼһ ͼ�� ͼ�� ͼ��
| A��ͼһ�о������¶ȡ�ѹǿ��ƽ���Ӱ�죬�������ʾѹǿ |
| B��ͼ���о������¶ȶ�ƽ���Ӱ�죬����õ��¶ȸ��� |
| C��ͼ����t0ʱʹ���˴�����ʹƽ��������Ӧ������� |
| D��ͼ����t0ʱ����ѹǿ��ʹƽ��������Ӧ������� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�����ܱ������еķ�ӦX(g)��Y(g) Z(g) ��H��0���������У�
Z(g) ��H��0����������
X(g)��Y(g) W(g) ��H��0��W(g)
W(g) ��H��0��W(g) Z(g) ��H��0������ͼʾ�йظ÷�Ӧ����Ϣ����������
Z(g) ��H��0������ͼʾ�йظ÷�Ӧ����Ϣ����������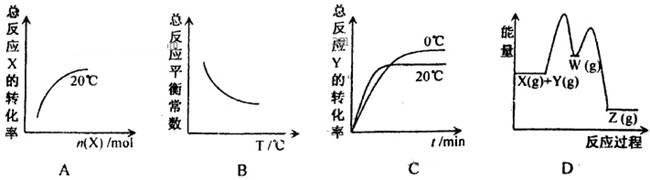
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴Ӧ2SO2(g)+O2(g) 2SO3(g)�������±��е������ж�����ͼ��������
2SO3(g)�������±��е������ж�����ͼ��������
 | pl(Mpa) | P2(Mpa) |
| 400�� | 99.6 | 99.7 |
| 500�� | 96.9 | 97.8 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶�ʱ�����ܱ������У�X��Y��Z��������Ũ�ȵı仯��ͼI��ʾ���������������䣬���¶ȷֱ�ΪT1��T2ʱ��Y�����������ʱ���ϵ��ͼ����ʾ�������н�����ȷ����
| A���÷�Ӧ���Ȼ�ѧ����ʽΪ����H��0 |
| B���������������䣬�����¶ȣ������淴Ӧ���ʾ�����X��ת���ʼ�С |
| C���ﵽƽ����������������䣬��С���������ƽ�����淴Ӧ�����ƶ� |
| D���ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ӦCu (s) + 2Ag+ (aq)  Cu2+ (aq) + 2Ag (s)��Ƴ�ԭ��أ�ijһʱ�̵ĵ����������ƣ�G��ָ��ƫת������ͼ��ʾ���й�������ȷ����
Cu2+ (aq) + 2Ag (s)��Ƴ�ԭ��أ�ijһʱ�̵ĵ����������ƣ�G��ָ��ƫת������ͼ��ʾ���й�������ȷ����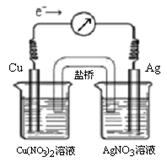
| A��KNO3�����е�K+����Cu(NO3)2��Һ |
| B����������ָ��Ϊ0ʱ���÷�Ӧ��ƽ�⣬ƽ�ⳣ��K=0 |
| C������ʱ��AgNO3��Һ�м���NaCl���壬����NaCl�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת |
| D������ʱ��Cu(NO3)2��Һ�м���NaOH���壬����NaOH�������ӵ�����ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ҵ�����������������Ⱦ���������·�Ӧ��
CH4(g)��2NO2(g) N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol
N2(g)��CO2(g)��2H2O(g) ��H��a kJ/mol
���¶�T1��T2ʱ���ֱ�0.50 molCH4��1.2 molNO2�������Ϊ1 L���ܱ������У����n(CH4)��ʱ��仯�������±���
| �¶� | ʱ��/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | ���� | 0.15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ͼʾ���Ӧ���������������
| A��ͼ1��ʾ��ͬ�¶��£���pH��10������������Һ�Ͱ�ˮ�зֱ��ˮϡ��ʱpH�ı仯���ߣ�����a��ʾ��ˮϡ��ʱpH�ı仯���� |
| B��ͼ2��ʾ���������������Ƶ�ƫ��������Һ�еμ��������ó������ʵ�������������Ĺ�ϵ |
C��ͼ3��ʾѹǿ�Կ��淴ӦCO(g)+H2O(g) CO2(g)+H2(g)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� CO2(g)+H2(g)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� |
| D��ͼ4��ʾ10 mL 0.01 mol��L-1 KMnO4������Һ�������0.1 mol��L��1 H2C2O4 ��Һ���ʱ��n(Mn2+) ��ʱ��ı仯��Mn2+�Ը÷�Ӧ�д����ã� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������������ѳ�ú���е�H2S���÷�Ӧԭ��Ϊ��
��Fe3O4 (s)+3H2S(g)+H2 (g) 3FcS(s)+4H2O(g) ��H=a kJ ? mol-1
3FcS(s)+4H2O(g) ��H=a kJ ? mol-1
��Fe2O3(s)+2H2S(g) + H2(g) 2FeS(s)+3H2O(g) ��H=bkJ ? mol-1
2FeS(s)+3H2O(g) ��H=bkJ ? mol-1
��FeO(s)+H2S(g)  FeS(s)+H2O(g) ��H=ckJ�� mol-1
FeS(s)+H2O(g) ��H=ckJ�� mol-1
�¶���ƽ�ⳣ���Ĺ�ϵ��ͼ�������й�˵����ȷ����
| A��a��b��c����0 |
| B��ѹǿԽ��H2S���ѳ���Խ�� |
| C���¶�Խ�ߣ�H2S���ѳ���Խ�� |
| D����Ӧ�١��ڡ��۵�ƽ�ⳣ������ʽ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ͼʾ���Ӧ������������� ( )
ͼ1 ͼ2 ͼ3 ͼ4
| A��ͼ1��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯 |
| B��ͼ2��ʾ0.1000 mol��L��1NaOH��Һ�ζ�20.00mL0.1000 mol��L��1CH3COOH��Һ���õ��ĵζ����� |
| C��ͼ3��ʾKNO3���ܽ�����ߣ�ͼ��a����ʾ����Һ��80��ʱKNO3�ı�����Һ |
| D��ͼ4��ʾij���淴Ӧ����������淴Ӧʱ��仯�����ߣ���ͼ֪tʱv�� > v�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com