
| A、K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B、NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
| C、NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D、金、银、铜金属活动性顺序逐渐减弱 |


科目:高中化学 来源: 题型:
| ||
| 含锌废水水质 | 国家环保标准值 | |
| Zn2+浓度/(mg.L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+ NO3- NH4+ |
| B、Na+ K+ SO32- |
| C、Ca2+ CO32- Cl- |
| D、ClO- Na+ NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
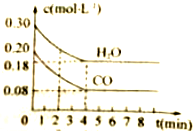 在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.328 | 0.062 | 0.062 |
| 3 | C1 | CO2 | C3 | C3 |
| 4 | C1 | CO2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | ||||
| B、S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g);△H1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下表及图中分别表示物质间的从属关系,其中不正确的是( )
以下表及图中分别表示物质间的从属关系,其中不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 含氧酸 |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | 非金属氧化物 |
| D | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com