
【题目】【化学——选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:

(1)W+的电子排布式为 ,Y2X2分子中![]() 键与π键数之比为 。
键与π键数之比为 。
(2)化合物ZX3比YX4易液化,主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ;如果该晶体的密度为d g·cm--3,阿伏加德罗常数为NA,则晶体中两个距离最近的氯离子中心间的距离为 cm。
(5)ZX3的VSEPR构型为 ,ZF3分子的空间构型为 ;ZX3容易与W2+形成配离子,但ZF3不易与W2+形成配离子,其原因是 _。
【答案】(1)[Ar]3d10(1分)3:2(2分)
(2)NH3分子间存在氢键,沸点高,易液化(2分)
(3)![]() (2分)
(2分)
(4)CuCl(2分)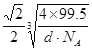 (2分)
(2分)
(5)四面体形(1分),三角锥形(1分);F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配位键(2分)
【解析】试题分析:原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,X是H;Y原子基态时最外层电子数是其内层电子数的2倍,Y是C;Z原子基态时2p原子轨道上有3个未成对的电子,Z是N;W的原子序数为29,W是Cu。
(1)铜的原子序数是29,则Cu+的电子排布式为[Ar]3d10,C2H2分子中含有2个碳氢单键和有关碳碳三键,则分子![]() 键与π键数之比为3:2。
键与π键数之比为3:2。
(2)NH3分子间存在氢键,沸点高,因此比甲烷易液化。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,这两种物质分别是CO2和N2O,根据CO2的结构式可知N2O的结构式是![]() 。
。
(4)根据晶胞的结构可知含有的原子个数分别是8×1/8+6×1/2=4、12×1/4+1=4,则化学式为CuCl;设晶胞的边长是acm,则晶体中两个距离最近的氯离子中心间的距离为![]() 。由于
。由于![]() ,所以晶体中两个距离最近的氯离子中心间的距离为
,所以晶体中两个距离最近的氯离子中心间的距离为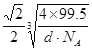 cm。
cm。
(5)NH3分子中氮元素的价层电子对数是4,所以其VSEPR构型为四面体形,NF3分子中氮元素的价层电子对数是4,但由于含有一对孤对电子,因此其分子的空间构型为三角锥形;由于F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配位键。


科目:高中化学 来源: 题型:
【题目】丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是
A. 蒸发 B. 分液 C.过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25mL的酸式滴定管中盛入0.1mol/L-1 HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L-1 NaOH溶液进行滴定,则所需NaOH溶液的体积
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验或操作不能达到目的的是( )
A. 制取溴苯:将铁屑、溴水、苯混合加热
B. 用 NaOH 溶液除去溴苯中的溴
C. 鉴别己烯和苯:向己烯和苯中分别滴入酸性 KMnO4 溶液,振荡,观察是否褪色
D. 除去甲烷中含有的乙烯:将混合气体通入溴水中
查看答案和解析>>
科目:高中化学 来源: 题型:
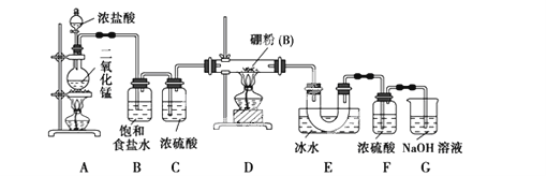
【题目】硼位于ⅢA族,三氯化硼 (BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂,三氯化硼遇水剧烈反应。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应
设计实验:某同学设计如图所示装置,利用氯气和单质硼反应制备三氯化硼
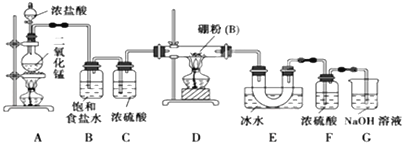
回答下列问题:
(1)写出A装置中反应的化学方程式 ,
(2)B的作用 ,C的作用 ,实验结束后在E中收集到的物质是 (填化学式)
(3)G的作用是吸收含Cl2尾气,写出G中反应的化学方程式 ,
(4)实验中可以用一个盛装 (填试剂名称)的干燥管代替F和G装置,使实验更简便。
(5)为了顺利完成实验,正确的操作是 (填序号)
①先点燃D处酒精灯,后点燃A处酒精灯
②先点燃A处酒精灯,后点燃D处酒精灯
③同时点燃A、D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓 (填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K[来 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;再充入CO2气体,则平衡 移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K (选“增大”、“减小”或“不变”)。
(2)该反应的逆反应方向为 反应方向(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) =CH3OH(g)。
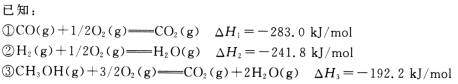
(1)计算CO(g)+2H2(g)=CH3OH(g)的反应热△H4=____________。
(2)为了提高燃料的利用率可以将甲醇设计为燃料电池,并用以此为电源进行电解实验,装置如图所示,回答相关问题。
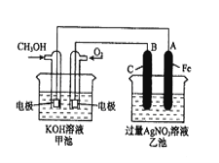
①写出通甲醇一极的电极反应方程式 ;写出乙池中B(C)电极的电极反应式 ;
②反应过程中,乙池溶液pH的变化为 (升 高、降低或不变)
③当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯和氢气,下列说法不正确的是
A. 乙苯的同分异构体共有三种
B. 该反应的类型为消去反应
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 苯乙烯分子中共平面的碳原子数最多为8个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com