


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| PH | 8.1 | 8.4 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
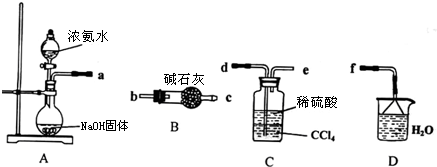
科目:高中化学 来源: 题型:
| 条件变化 | 平衡移动方向 | n(OH-)的变化 | c(OH-)的变化 |
| ①溶液温度升高5℃ | |||
| ②通入少量氨气 | |||
| ③加水稀释 | |||
| ④加入少量氢氧化钠固体 | |||
| ⑤加入少量氯化铵固体 | |||
| ⑥通入少量二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a1>a2 |
| B、a1<a2 |
| C、a1=a2 |
| D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com