
| A. | 正常雨水PH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,可用泡沫灭火器灭火 | |
| C. | 在放电条件下,氮气和氧气化合生成二氧化氮 | |
| D. | 冷的浓硫酸与铁、铝反应时会使金属表面生成致密的氧化物而钝化 |
分析 A.正常的雨水因为溶解了少量的二氧化碳气体而显弱酸性,雨水的pH只是稍小于7,当雨水中溶解了二氧化硫、二氧化氮等物质时,雨水的酸性会明显增强,当达到一定程度时就形成酸雨,pH只是稍小于5.6;
B.Na的性质活泼,易与水反应、与空气中的氧气在点燃或加热时反应生成过氧化钠,过氧化钠能分别与水、二氧化碳反应;
C.放电条件下氮气和氧气反应生成一氧化氮;
D.硫酸具有强氧化性,常温下可使铁、铝钝化.
解答 解:A.正常雨水中因为溶有二氧化碳而显酸性,正常雨水的pH约为5.6,但酸雨的pH却小于5.6,故A错误;
B.金属钠着火时,与空气中的氧气反应生成过氧化钠,过氧化钠与水、二氧化碳反应,而干冰灭火器和泡沫灭火器都生成二氧化碳,只能用干燥沙土盖灭,故B错误;
C.在放电条件下,氮气和氧气化合生成一氧化氮,不能生成二氧化氮,故C错误;
D.浓硫酸具有强氧化性,在常温下可使铁在表面生成一层致密的氧化膜而钝化,故D正确;
故选D.
点评 本题考查酸雨、钠、氮气、浓硫酸的性质,为高考高频考点,侧重于学生的基础知识的综合理解和运用的考查,注意把握浓硫酸的特性以及性质之间的区别,难度不大,注意相关基础的积累.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 3:5 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液 | B. | BaCl2溶液 | C. | Fe2(SO4)3溶液 | D. | CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着化学科学的发展和提高,自然界的一切都将以人的意志为转移 | |
| B. | 生物固氮是指植物通过叶面直接吸收空气的氮气 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 绿色食品是不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
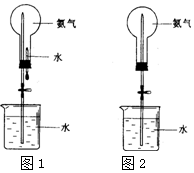 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 碳酸钠水解:CO32-+H2O═HCO3-+OH- | |
| C. | 食醋滴到鸡蛋壳上:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将铜粉加入稀硫酸中:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 加热前质量 | 加热后质量 | |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 5.4g | 7.9g | 6.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com