
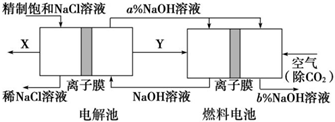
分析 电解池中发生反应:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,产生的氢气作为燃料,通入燃料的极作负极,电极反应式为:H2+2OH--2e-=2H2O,空气通入燃料电池的正极,电极反应式为:O2+4e-+2H2O=4OH-,总反应为2H2+O2=2H2O,据此分析解答.
解答 解:(1)电解池中发生反应:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,产生的氢气作为燃料,通入燃料的极作负极,则Y是氢气,在X处产生的是氯气;燃料电池正极上氧气得电子和水反应生成氢氧根离子,导致正极区域氢氧化钠浓度增大,所以a<b,
故答案为:Cl2;H2;<;
(2)燃料电池的工作原理:负极是燃料氢气失电子发生氧化反应,即H2+2OH--2e-=2H2O,
故答案为:H2+2OH--2e-=2H2O;
(3)电解池中发生反应:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(4)根据电子转移守恒建立关系式,电解池中:2NaOH~2e-,要电解制得2.4molNaOH,转移电子2.4mol,原电池中:O2~4e-,转移2.4mol电子时消耗氧气0.6mol,但该装置的能量利用率可达70%,所以实际上氧气消耗的物质的量为:0.6mol÷70%,氧气的体积为0.6mol÷70%×22.4L/mol,则空气的体积为:0.6mol÷70%×22.4L/mol÷20%=96L,
故答案为:96.
点评 本题考查学生燃料电池和氯碱工业的有关知识,要求学生具有分析和解决问题的能力,注意第(4)题用电子转移守恒解题,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
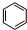 ,丁CH3CH2OH
,丁CH3CH2OH +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$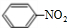 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A组 | B组 |
| Ⅰ.H-I键的键能大于H-Cl键的键能 Ⅱ.H-I键的键能小于H-Cl键的键能 Ⅲ.H-I键的键能小于H-Cl键的键能 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HCl比HI稳定 ③HI沸点比HCl低 ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
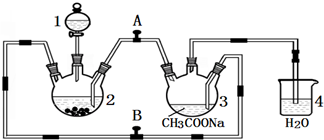
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
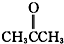 酮类 ③CH3CH2Br卤代烃
酮类 ③CH3CH2Br卤代烃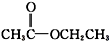 酯类 ⑤
酯类 ⑤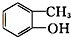 酚类 ⑥
酚类 ⑥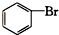 卤代烃
卤代烃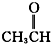 醛类 ⑧
醛类 ⑧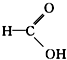 羧酸类 ⑨
羧酸类 ⑨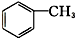 芳香烃.
芳香烃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com