
| A. | 实验结果随反应物用量改变而改变 | |
| B. | 实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和 | |
| C. | 实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒 |
分析 A、中和热是指稀的强酸和强碱之间反应生成1mol水所放出的热量;
B、为了保证酸碱之间完全中和,往往需要一方过量;
C、铜质搅拌棒的传热能力大于环形玻璃搅拌棒.
解答 解:A、中和热是指稀的强酸和强碱之间反应生成1mol水所放出的热量,实验结果不会随反应物用量改变而改变,故A错误;
B、为了保证酸碱之间完全中和,往往需要一方过量,实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和,故B正确;
C、铜质搅拌棒的传热能力大于环形玻璃搅拌棒,为了减少能量损失,不可用环形铜质搅拌棒代替环形玻璃搅拌棒,故C正确.
故选A.
点评 中和热指的是强酸和强碱的稀溶液发生中和反应生成1mol水释放的热量,是一个定值,这是解题的关键,难度不大.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 用金属钠分别与同浓度苯酚和乙醇的水溶液反应,比较两者羟基氢(-OH)的活泼性 | |
| B. | 石墨作电极,电解Cu(NO3)2、AgNO3 的混合溶液,比较金属铜和银的金属活动性 | |
| C. | 分别测定CH4 和H2S 的沸点高低,比较硫和碳两种元素的非金属性强弱 | |
| D. | 用检验Na2CO3 和Na2SO3 水溶液酸碱性实验,比较碳和硫两元素非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 氨水体积/mL | 40 | V1 | 30 | 20 |
| 盐酸体积/mL | 20 | 60-V1 | 30 | 40 |
| A. | ①所得溶液中,c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+) | |
| B. | 若②所得溶液pH=7,则c(NH4+)=c(C1-)=1×10-7mo1•L-1 | |
| C. | ③所得溶液中.c(H+)-c(OH-)=c(NH3•H2O) | |
| D. | ④所得溶液中,c(C1-)=2c(NH3•H2O)+2c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3粉末(NaHCO3),加热直至固体质量不再减少 | |
| B. | NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体 | |
| C. | CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中 | |
| D. | H2(HCl),将气体通入碱石灰中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
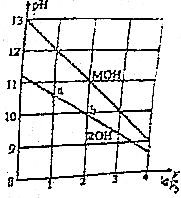 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳极的离子 和电极反应式 | 阴极的离子 和电极反应式 | 电解总反应式 | 溶液浓度变化 | 溶液pH的变化 | |
| HCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | 减小 | 增大 |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Br2+Cu | 减小 | 增大 |
| KCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | 减小 | 增大 |
| CuSO4 | 4OH--4e-=O2↑+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | 减小 | 增大 |
| NaOH | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 增大 |
| H2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 减小 |
| KNO3 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
| Na2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:填空题
典型金属元素及化合物的特征性质有着重要的应用,请按要求回答:
(1)Na、Al、Fe、Cu四种元素的单质中:
①Al与NaOH溶液反应的离子方程式是____________,其中作氧化剂的是_______。
②Cu在潮湿的空气中被腐蚀的化学方程式是_______________。
(2)上述四种金属的氧化物中:
①写出能用作供氧剂的一个化学方程式:___________________。
②既能溶于酸溶液又溶于强碱溶液,写出溶于强碱溶液的离子方程式_______________。
③常温下为黑色固体的是_________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的现象是_______________。
②具有两性的是_________________。
(4)上述四种金属形成的阳离子共__________有种,其中既能表现还原性,又能表现氧化性的是__________;其中氧化性最强的是__________。
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
新型陶瓷AlN可通过反应: Al2O3+N2+3C 2AlN+3CO合成。下列正确的是( )
2AlN+3CO合成。下列正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.AlN中氮元素的化合价为+3
C.上述反应中,每生成1 mol AlN需转移3 mol电子
D.AlN的摩尔质量为41 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com