
 I����������һ����Ҫ���������ȼ��j���������������������Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ���ش��������⣺
I����������һ����Ҫ���������ȼ��j���������������������Գ��������ƻ����ã���ҵ�Ͽ�����ú���������ˮú�����ϳɶ����ѣ���ش��������⣺| 3��0.75 |
| 3 |
| ||
| 0.05 |
| 0.5 |
| 1.0��10-14 |
| 0.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʹKSCN��Һ�Ժ�ɫ����Һ��K+��NH4+��Cl-��NO3- |
| B�������£�ǿ������Һ�У�Na+��NH4+��ClO-��I- |
| C�������̪��Һ�Ժ�ɫ����Һ��Mg2+��Al3+��Br-��SO42- |
| D�����ܽ�Al2O3����Һ��Na+��Ca2+��HCO3-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��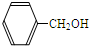 |
B�� |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧ�� | ��ѧ����ʽ | ��Ӧ���� | |
| ��1���뱽����ȡ����Ӧ | ���� |
||
| ��2����ʾ��Խ��Խ���ԭ�� | �ߺ� |
||
| ��3��˵���������Ա�̼��ǿ | �ۺ� |
||
| ��4������ʱ����ζ��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | ���ֽṹ֪ʶ | �������� |
| X | X�ĵ�����˫ԭ�ӷ��ӹ��ɣ���������14������ | X�ж����������XO��XO2��X2O4�ȣ�ͨ�������XO2��X2O4���� |
| Y | Yԭ�ӵĴ�������������������������һ�� | Y���γɶ�����̬�⻯�� |
| Z | Zԭ�ӵ���������������4 | ZԪ�ص���������ϼ���������ϼ۴����͵���6 |
| W | Wԭ�ӵ���������������2n-3��nΪԭ�Ӻ�����Ӳ����� | ��ѧ��Ӧ��Wԭ����ʧȥ���������γ�Wn+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2mol |
| B��4 mol |
| C��7mol |
| D��8 mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com