
| A��10ml��������Ϊ98%��H2SO4����10mlˮϡ�ͺ�H2SO4��������������49% |
| B������0.1mol/L��Na2CO3��Һ480ml������500ml����ƿ |
| C���ڱ���£���22.4L��������1Lˮ�У��õ�1mol/L�İ�ˮ |
| D����2�ȷݲ����͵��ռ���Һ�зֱ����һ������Na2O2��Na2O��ʹ��Һ��ǡ�ñ��ͣ�������Na2O2��Na2O�����ʵ���֮�ȵ���1��1�������¶Ȳ��䣩 |
| n |
| V |
| 10mL����1��98% |
| 10mL����1+10mL����2 |
| 1 | ||
1+
|


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����H��0 |
| B��a+b��c+d |
| C���¶����ߣ�ƽ�ⳣ������ƽ�����淴Ӧ�����ƶ� |
| D������A������ƽ��������Ӧ�����ƶ���A��ת������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CO��g����ȼ���ȣ���H=-283.0kJ/mol����2CO2��g��=2CO��g��+O2��g����Ӧ�ġ�H=+566.0kJ/mol |
| B����֪NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H=-57.3 kJ?mol-1����40.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�57.3kJ������ |
| C����֪2C��s��+2O2��g��=2CO2��g����H=a��2C��s��+O2��g��=2CO��g������H=b����a��b |
| D����֪C ��ʯī��s��=C �����ʯ��s����H��0����ʯī�Ƚ��ʯ�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
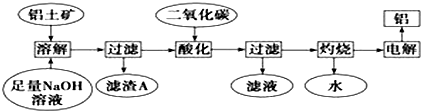
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��25% | B��50% |
| C��75% | D����ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com