
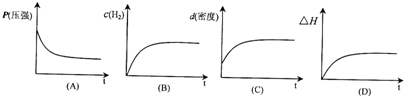
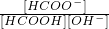 与稀释前比较______(填字母)
与稀释前比较______(填字母)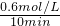 =0.06mol/(L.min),
=0.06mol/(L.min),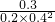 =9.375(mol/L)-2,
=9.375(mol/L)-2,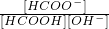 =
=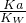 ,则比值不变,故答案为:C;
,则比值不变,故答案为:C;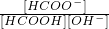 =
=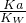 ;
;

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:广东省高考真题 题型:填空题
反应①:
反应②:
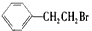 通过消去反应制备I的化学方程式_____________________(注明反应条件)。
通过消去反应制备I的化学方程式_____________________(注明反应条件)。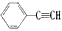 和H2二者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有____(双选,填字母)。
和H2二者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有____(双选,填字母)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com