
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
【答案】D
【解析】A项,向0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全时发生反应为:NH4HSO4+Ba(OH)2=BaSO4↓+NH3H2O+H2O,电离方程式为:NH3H2O![]() NH4++OH-,H2O
NH4++OH-,H2O![]() H++OH-,所以c(OH-)应大于c(NH4+),故A错误;B项,将CO2通入0.1mol/LNa2CO3溶液至溶液中性,根据电荷守恒:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),c(OH-)=c(H+),则2c(CO32-)+c(HCO3-)=c(Na+),又因为c(Na+)=0.2mol/L,所以2c(CO32-)+c(HCO3-)=0.2mol/L,故B错误;C项,0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,发生反应:NaOH+HCN=NaCN+H2O,反应后溶液为NaCN和HCN等物质的量的混合溶液,因为所得溶液呈碱性,说明CN-的水解程度大于HCN的电离程度,所以各微粒的大小关系为:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故C错误;D项,由已知反应为:4Cl2+8KOH=6KCl+KClO+KClO3+4H2O,溶液中电荷守恒为:c(K+)+c(H+)=c(Cl-)+c(ClO3-)+c(ClO-)+c(OH-),氧化还原反应得失电子守恒为:c(Cl-)=5c(ClO3-)+c(ClO-)+c(HClO),将电子守恒等式代入上式得,c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-),故D正确。
H++OH-,所以c(OH-)应大于c(NH4+),故A错误;B项,将CO2通入0.1mol/LNa2CO3溶液至溶液中性,根据电荷守恒:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),c(OH-)=c(H+),则2c(CO32-)+c(HCO3-)=c(Na+),又因为c(Na+)=0.2mol/L,所以2c(CO32-)+c(HCO3-)=0.2mol/L,故B错误;C项,0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,发生反应:NaOH+HCN=NaCN+H2O,反应后溶液为NaCN和HCN等物质的量的混合溶液,因为所得溶液呈碱性,说明CN-的水解程度大于HCN的电离程度,所以各微粒的大小关系为:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故C错误;D项,由已知反应为:4Cl2+8KOH=6KCl+KClO+KClO3+4H2O,溶液中电荷守恒为:c(K+)+c(H+)=c(Cl-)+c(ClO3-)+c(ClO-)+c(OH-),氧化还原反应得失电子守恒为:c(Cl-)=5c(ClO3-)+c(ClO-)+c(HClO),将电子守恒等式代入上式得,c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-),故D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是 :
A.1mol气体的体积主要由微粒的大小决定
B.标准状况下,气体摩尔体积约为22.4L
C.若1molCH4的体积约为22.4L,则一定处于标准状况
D.20℃、101KPa时,气体摩尔体积大于22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 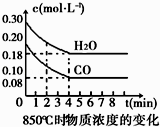
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为  ,有关滴滴涕的说法正确的是( )
,有关滴滴涕的说法正确的是( )
A.它属于芳香烃
B.分子中最多有23个原子共面
C.分子式为C14H8Cl5
D.1mol该物质最多能与5mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.标准状况下,1L庚烷所含有的分子数为 ![]()
B.1mol甲基(﹣CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA
D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 胶体、分散系、混合物
C. 复分解反应、置换反应、化学反应
D. 碱性氧化物、金属氧化物、氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯( ![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: 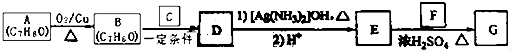 已知以下信息:
已知以下信息:
① ![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22.
回答下列问题:
(1)A的化学名称为 .
(2)B和C反应生成D的化学方程式为 .
(3)F中含有官能团的名称为 .
(4)E和F反应生成G的化学方程式为 , 反应类型为 .
(5)F的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为写结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com