
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.03mol |
| B、0.02mol |
| C、大于0.02mol |
| D、小于0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油和水、CCl4和水两组物质,都能用分液漏斗进行分离 |
| B、在1L 5.0mol/L HCl溶液中取出了10 mL,取出的HCl溶液其浓度为5.0 mol/L |
| C、分散系根据分散质粒子大小可分为溶液、胶体、浊液 |
| D、0.5 molCuO的摩尔质量为40g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
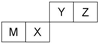
| A、X 的最简单气态氢化物的热稳定性比Z的小 |
| B、Z位于元索周期表中第2周期、第ⅥA族 |
| C、原子半径Z<M |
| D、Y的最高价氧化物对应水化物的酸性比X 的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com