
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
分析 1mol某烃最多能与2molHCl发生加成反应,可知含1个碳碳三键或2个碳碳双键,生成的产物最多能与8mol Cl2发生取代反应,则生成物中含8个H,原不饱和烃中8-2=6个H,以此来解答.
解答 解:1mol某烃最多能与2molHCl发生加成反应,可知含1个碳碳三键或2个碳碳双键,生成的产物最多能与8mol Cl2发生取代反应,则生成物中含8个H,原不饱和烃中8-2=6个H,而C3H6不含1个碳碳三键或2个碳碳双键,只有C4H6符合,
故选A.
点评 本题考查有机物分子式计算的确定,为高频考点,把握加成反应、取代反应中化学键及H原子个数的变化为解答的关键,侧重分析与应用能力的考查,注意烃中不饱和度的判断,题目难度不大.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
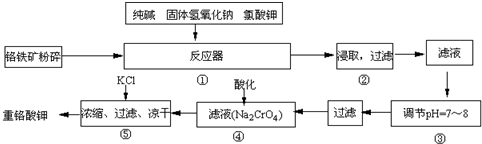
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 盐酸 | B. | 氯化铵水溶液 | C. | 硝酸钠水溶液 | D. | 氢氧化钠水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
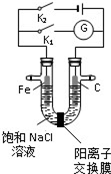
| A. | K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 | |
| B. | K1或 K2闭合,石墨棒周围溶液 pH 均升高 | |
| C. | K2闭合,铁棒上发生的反应为 2Cl--2e-═Cl2↑ | |
| D. | K2闭合,电路中通过 0.002NA个电子时,两极共产生 0.002mol 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何酸、碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富,仅次于铁 | |
| D. | 工业上通常用钠与铝盐溶液反应来制备铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com