
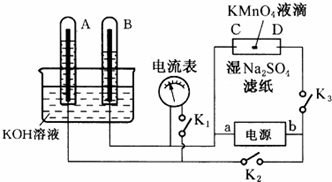
分析 (1)根据A、B两电极得到的气体体积判断电极名称,从而确定电源a、b电极名称;
(2)先判断C、D 的电极名称,判断电解时溶液中离子的移动方向;
(3)切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池;A极上氧气得电子.
解答 解:(1)切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,故a是负极;
故答案为:负;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子钾离子向阴极移动,阴离子高锰酸根离子向阳极移动,所以D极呈紫色;电解质溶液中氢离子和氢氧根离子放电,所以在两极上都得到气体.
故答案为:紫色向D方向移动,两极有气体产生;
(3)切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动;B极上氢气失电子生成水,A极上氧气得电子生成氢氧根离子,则电极反应式为2H2O+O2+4e-=4OH-;
故答案为:是;2H2O+O2+4e-=4OH-.
点评 本题考查了原电池、电解池工作原理,写电极反应式要注意结合电解质溶液书写,如果电解质溶液不同,虽然原料相同,电极反应式也不同,如氢氧燃料电池,当电解质为酸或碱,电极反应式就不同,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
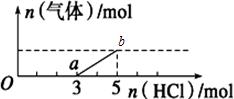
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
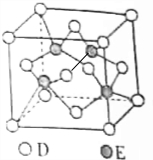 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法利用的是原电池原理 | |
| B. | Fe2+能与[Fe(CN)6]3-反应生成带有特征蓝色的沉淀 | |
| C. | 电解质溶液的导电过程一定是电解质溶液的电解过程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,则Na2CO3溶液的最初浓度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA | |
| C. | 92 g NO2和N2O4混合气体中含有氧原子总数为4NA | |
| D. | 标况下,22.4升SO3含有原子总数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1 CH3COOH溶液 | |
| B. | 10-3 mol•L-1 H2SO4浓缩到原体积的10倍. | |
| C. | pH=1的H2SO4溶液稀释10倍 | |
| D. | c(OH-)=10-2 mol•L-1 的某溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入氢氧化钠溶液中:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com