
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1HCl溶液,溶液中[H+]减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
科目:高中化学 来源: 题型:
一定条件下,分别对反应A(s)+B(g) 2C(g) (正反应吸热)进行如下操作(只改变该条件):
2C(g) (正反应吸热)进行如下操作(只改变该条件):
①增大A的用量 ②缩小容器的容积 ③升高体系温度 ④减小体系中C的量
上述措施中一定能使正反应速率加快的是
A.①③ B.②③ C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是____________________________________。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
①装置中由NaCl转化为NaClO过程中的离子方程式__________________、__________________,总的离子方程式______________。
②海水中含有Ca2+、Mg2+、HCO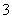 等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是____________________________。
等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是____________________________。

③若每隔5~10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
B.C2H2(g)+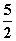 O2(g)===2CO2(g)+H2O(l) ΔH=2b kJ·mol-1
O2(g)===2CO2(g)+H2O(l) ΔH=2b kJ·mol-1
C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________。
又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1。则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
________________________________________________________________________
________________________________________________________________________。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成盐的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)水电离生成H3O+和OH-叫作水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY>HX B.结合H+的能力Y->CO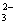 >X->HCO
>X->HCO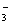
C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 D.HX和HY酸性相同但比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
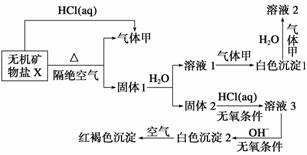
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。
请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式______________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是__________________________________(用化学反应方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com