
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
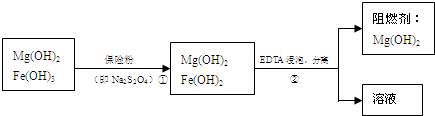
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度T/℃ | 加入EDTA质量(g) | 加入保险粉质量(g) | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?百色二模)某化学兴趣小组的同学想验证Mg与CO2的反应.可以选用的药品:浓硫酸、稀盐酸、稀硫酸、镁粉、大理石、澄清石灰水、饱和NaHCO3溶液、饱和Na2CO3溶液可以选用的装置:如右图所示(必要时装置可重复使用,彼此连接成一套完整的实验装置)
(2012?百色二模)某化学兴趣小组的同学想验证Mg与CO2的反应.可以选用的药品:浓硫酸、稀盐酸、稀硫酸、镁粉、大理石、澄清石灰水、饱和NaHCO3溶液、饱和Na2CO3溶液可以选用的装置:如右图所示(必要时装置可重复使用,彼此连接成一套完整的实验装置)| 选用的装置 | 加入的剂 | 作用 |
A A |
稀盐酸、大理石 稀盐酸、大理石 |
产生CO2气体 产生CO2气体 |
B B |
饱和的NaHCO3溶液 饱和的NaHCO3溶液 |
除去二氧化碳中的氯化氢杂质 除去二氧化碳中的氯化氢杂质 |
B B |
浓H2SO4 浓H2SO4 |
干燥二氧化碳气体 干燥二氧化碳气体 |
C C |
镁粉 镁粉 |
镁和二氧化碳反应 镁和二氧化碳反应 |
| B | 澄清石灰水 | 吸收多余CO2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷(带解析) 题型:填空题
(1)除去Mg粉中的Al粉的离子方程式为 ;
(2)除去FeCl2溶液中少量CuCl2杂质的试剂是 ,离子方程式为 ;
(3)加热条件下铁与水蒸气反应的化学反应方程式为 ;
(4)Fe(OH)2露置于空气中转化Fe(OH)3的化学反应方程式为 ;
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷(解析版) 题型:填空题
(1)除去Mg粉中的Al粉的离子方程式为 ;
(2)除去FeCl2溶液中少量CuCl2杂质的试剂是 ,离子方程式为 ;
(3)加热条件下铁与水蒸气反应的化学反应方程式为 ;
(4)Fe(OH)2露置于空气中转化Fe(OH)3的化学反应方程式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com