
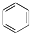
 ②
② ③
③ ④
④ ⑤
⑤
分析 (1)根据各有机物的结构简式写出其分子式;
(2)分析该有机物的分子式变化规律,总结出该组化合物的通式;
(3)根据并五苯的结构特点计算出等效氢原子数目即可.
解答 解:(1)②的分子式为C10H8,③的分子式为C14H10,④的分子式为C18H12,⑤的分子式为C22H14;
故答案为:C10H8;C14H10;C18H12;C22H14;
(2)萘比苯多4个C原子、2个氢原子,所以萘的分子式为C10H8,依次可写蒽、并四苯…的分子式,这组化合物分子组成的公差是“C4H2”,所以这组化合物分子式可表示成:C2H4+(C4H2)m即:C4m+2H2m+4;
故答案为:4m+2;2m+4;
(3)由并五苯的结构简式可知,其分子中含有4种化学环境的H,所以其一氯代物有4种;
故答案为:4.
点评 本题考查了有机物分子式的确定,同分异构体数目的求算,题目难度较大,注意掌握寻找有机物分子通式的方法.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲烷的质量与甲烷的摩尔质量相等 | |
| B. | 28 g氮气与40 g氩气所含的原子数目相等,都是NA个 | |
| C. | 2.3 g钠和过量氧气反应,失去的电子数为0.1NA | |
| D. | 18 g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com