
【题目】下列各组物质的熔点均与所含化学键的键能有关的是
A. CaCl2、SiO2 B. NaCl、HCl C. CaO、CO2 D. Cl2、I2
科目:高中化学 来源: 题型:
【题目】 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
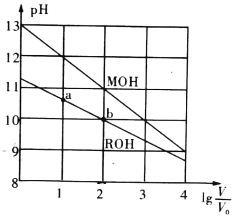
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对人体健康和人类生活有着十分重要的作用。请回答下列问题:
(1)抗胃酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。请写出NaHCO3、Al(OH)3与胃酸(以HCl表示)作用的化学方程式: 、_____________。某品牌抗酸药的主要成分有糖衣、碳酸氢钠、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式:___________________、__________________。
(2)甲同学患了夜盲症,可能的原因之一是体内缺少维生素 (A、B、C、D、 E、K,下同);乙同学在刷牙时牙龈经常出血,该同学在平时应多吃富含维生素 的食物。
(3)铝的金属活动性比较强,铝在空气中却比较稳定,其原因是_________________
(4)有一种抗酸药,其有效成分是CaCO3,为测定每一片药片中CaCO3的质量,现取一片药片,研成粉末,再与足量盐酸反应,收集到标准状况下的CO2气体22.4mL.则CaCO3与足量盐酸反应的化学方程式为 ,每一片药片中CaCO3的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式下列判断正确的是

A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜结晶水合物中结晶水含量的定量实验中,会导致结果偏大的是
A. 未达恒重即停止实验 B. 加热时有晶体溅出
C. 黏在玻璃棒上固体刮入坩埚 D. 固体加热至淡蓝色即停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=____________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是_______。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH向电极____移动(填a或b),负极的电极反应式为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式与所述事实相符且正确的是
A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH- = H2O
B.以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 用蒸馏的方法将自来水制成蒸馏水
B. 用酒精萃取碘水中的碘
C. 在容量瓶上无需标出所配溶液的浓度
D. 胶体区别于其他分散系的本质特征是分散质离子直径在1nm~10nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的Cl-扩散到孔口,并与各电极产物作用生成多孔粉状锈Cu2(OH)3Cl下列说法不正确的是
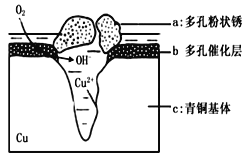
A.腐蚀过程中,负极c被氧化
B.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C.若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D.正极的电极反应式为:正极反应是 O2+ 4e-+2H2O=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com