

分析 (1)C中锌比铜铁活泼,能与稀硫酸反应,构成原电池,Zn是负极,Fe是正极;A没有形成闭合回路,不能形成原电池,B形成闭合回路,形成原电池,Fe是负极,Sn是正极,根据原电池的组成条件和工作原理解答该题;
(2)金属的化学腐蚀是将化学能转化为热能,原电池装置是将化学能转化为电能的装置;
(3)Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热的非氧化还原反应;
(4)金属的腐蚀速率:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀.
解答 解:(1)C中锌比铜铁活泼,能与稀硫酸反应,构成原电池,Zn是负极,Fe是正极;A没有形成闭合回路,不能形成原电池,B形成闭合回路,形成原电池,Fe是负极,Sn是正极;A.B中铁片是负极,C中铁片是正极,故正确;
B.B形成闭合回路,形成原电池,Fe是负极,Sn是正极,铁片表面不会有气泡产生,故错误;
C.A、B两烧杯中硫酸溶液都会被消耗,所以酸性减弱,溶液的pH均增大,故正确;
D.B形成原电池,A不会,原电池可以加快反应速率,所以产生气泡的速率A中比B中慢,故正确;
E.B形成闭合回路,形成原电池,Fe是负极,Sn是正极,外电路中电流方向Sn→Fe,故错误;
F.B中Fe是负极,Sn是正极,SO42-向负极Fe电极移动,故错误;
故选:ACD;
(2)A中金属Fe的化学腐蚀,是将化学能转化为热能,B是原电池,原电池装置是将化学能转化为电能的装置;故答案为:化学能转化为热能;化学能转化为电能;
(3)Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热的非氧化还原反应,不能设计成原电池,故答案为:否;该反应不是氧化还原反应;
(4)金属的腐蚀速率:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀,A没有形成闭合回路,不能形成原电池,属于化学腐蚀,B形成原电池,Fe是负极,Sn是正极,C中铁片是正极,被保护,所以三个烧杯中铁的腐蚀速率B>A>C,故答案为:B;A;C.
点评 本题考查学生原电池的工作原理以及金属的腐蚀速率知识,注意知识的迁移应用是关键,难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
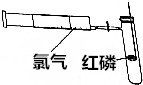 已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.
已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
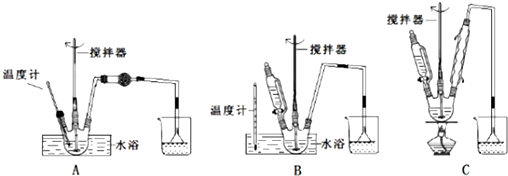
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
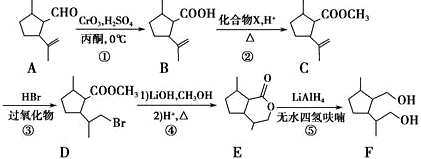
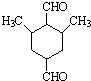 .
.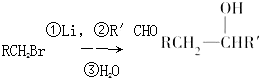
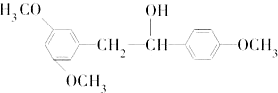 是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以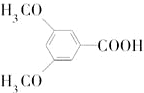 、
、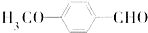 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: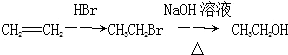
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
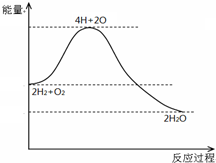
| A. | H2与O2反应是放热反应 | |
| B. | 断开化学键要放出能量 | |
| C. | 化学反应伴随着物质变化和能量变化 | |
| D. | 2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com