
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN + H2O2 + H2O = NaHCO3 + NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是( )
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.0.1 mol·L-1 NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D.实验室配制NaCN溶液时,需加入适量的NaOH溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
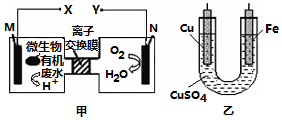
| A. | 质子透过离子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7mol•L-1•min-1 | B. | v (B)=0.3mol•L-1•min-1 | ||
| C. | v (C)=0.9mol•L-1•min-1 | D. | v (D)=0.8mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列离子反应方程式中,属于水解反应的是( )
A.NH4++H2O=NH3·H2O+H+
B.CO32-+H2O H2CO3-+2OH-
H2CO3-+2OH-
C.HCO3-+H2O=H++CO32-
D.CH3COO-+H2O CH3COOH+
CH3COOH+ OH-
OH-
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
盐酸普鲁卡因(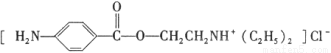 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
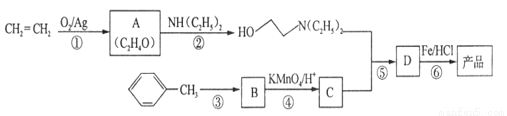
已知:①
②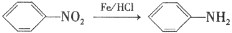
③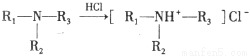
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为 。
(2)C的结构简式为 ,C中含有的含氧官能团的名称为 。
(3)合成路线中属于氧化反应的有 (填序号),反应③的反应类型为 。
(4)反应⑤的化学反应方程式为 。
(5)B的某种同系物E,相对分子质量比B大14,其中—NO2与苯环直接相连,分子的核磁共振氢谱有3个峰,则E的结构简式为 (写一种)。
(6)符合下列条件的E的同分异构体的数目有 种。
① 结构中含有一个“—NH2”与一个“—COOH”
② 苯环上有三个各不相同的取代基
(7)苯丙氨酸(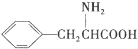 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A.只有①② B.只有①③ C.只有②③ D.只有③④
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
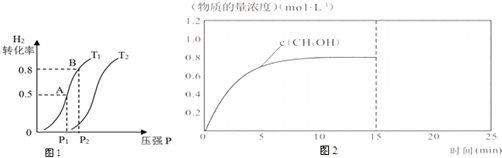
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com