
下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
 D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:选择题
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
B | 向Na2O2水溶液中滴入酚酞先变红后褪色 | Na2O2有漂白性 | Ⅰ对,Ⅱ错,无 |
C | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可用于航天员的供氧剂 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,2.24 L H2O中分子的数目为0.1 NA
B.0.1 mol·L-1 NH4Cl溶液中 含有Cl-的数目为0.1 NA
含有Cl-的数目为0.1 NA
C.常温下,1.7 g NH3中含有氢原子数目为0.3 NA
D.5.6 g铁粉在足量稀盐酸反应,产生的H2的数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量烧碱固体 B.加少量CH3COONa固体
C.加少量冰醋酸 D.加水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小或不变
C.△H<0、△S<0的反应一定能自发进行
D.△H>0、△S<0的反应一定不能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是放热反应的是( )
A.氢氧化钠与稀硫酸反应
B.钠箔在Cl2中的燃烧
C.Ba(OH)2•8H2O与NH4Cl的反应
D.灼热的炭与水蒸气反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl―+ClO―
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.大理石溶于醋酸的反应CaCO3+2CH3COOH==Ca(CH3COO)2↓+CO2↑+H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3―+Ba2++2OH―=BaCO3↓+2H2O+CO32―
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:填空题
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________(填“正”或“逆”)反应方向移动;溶液中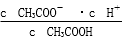 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5 mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L -1H2A溶液稀释到20倍后,溶液的pH=__________。
-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________ 。
。
A.盐酸多 B.H2A多 C .一样多 D.无法确定
.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:选择题
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
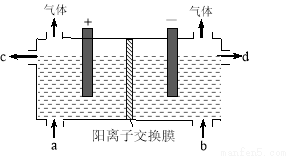
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com