
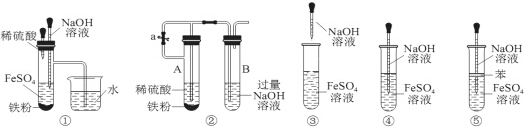
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ①②③④ | D. | ②④⑤ |
分析 氢氧化亚铁能够与空气中氧气发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,要较长时间保存Fe(OH)2沉淀,只要满足在制取过程中尽可能减少和空气接触即可,据此对各选项进行判断.
解答 解:根据题中信息可知要较长时间保存Fe(OH)2沉淀,必须在制取过程中尽可能减少和空气接触,
对比5个实验明显可以发现选项⑤加入有机物作隔离层和空气接触少,②中Fe和稀硫酸生成氢气能排出装置中的氧气,所以也能减少与氧气接触,①中盛有氢氧化钠溶液的滴管伸入放有还原性铁粉的硫酸亚铁溶液中,可以避免试管中部分氧气对氢氧化亚铁的氧化,则能减少与氧气接触;
③④生成的氢氧化亚铁能够与空气中氧气发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,导致不能长时间观察到氢氧化亚铁,
故选B.
点评 本题考查了氢氧化亚铁的制取,题目难度中等,氢氧化亚铁极易被氧气氧气,所以制取氢氧化亚铁时注意必须在无氧气条件下进行反应,这是高中化学中较重要的一个实验,是学习重点,注意熟练掌握反应方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
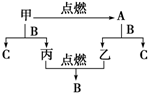 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.完成下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 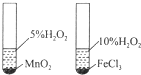 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 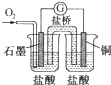 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | 向一定量NaOH溶液中加入稀H2SO4 | 向一定量铁粉和铜粉的混合物中加入硫酸铜溶液 | 向相等质量的锌粉和铁粉中,分别加入质量分数相同的稀盐酸 |
 |  |  | 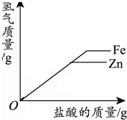 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体常用于净水 | |
| B. | 实验室制氢气时加CuSO4可加快反应速率 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室通常使用热的纯碱溶液去除油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序:rZ>rY>rX>rW | |
| B. | 单质Z易溶在元素Q和Z形成的化合物QZ2中 | |
| C. | Q、Y的最高价氧化物的水化物之间能发生反应 | |
| D. | 在相同条件下Z元素的氢化物沸点高于W元素的氢化物沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com