
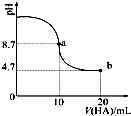
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
分析 A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性;
B.当加入HA溶液10ml时,恰好完全反应得到NaA溶液,溶液的PH=8.7,溶液c(OH-)=10-5.3mol/L;
C.a点溶质为NaA溶液,根据物料守恒判断;
D.b点溶质为等浓度的NaA和HA,HA的电离程度较小,则c(HA)>c(H+).
解答 解:A.a点时氢氧化钠与HA恰好反应生成NaA,由于A-的水解程度较小,则c(HA)<c(A-),故A错误;
B.当加入HA溶液10mL时,$\frac{{K}_{W}}{c({H}^{+})}$=c(OH-)=10-5.3mol/Lmol/L>1.0×10-7mol•L-1,故B错误;
C.a点所示溶液中溶质为NaA,根据物料守恒可得:c(Na+)=c(A-)+c(HA),故C正确;
D.b点加入20mLHA溶液,反应后溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于A-的水解程度,则:(A-)>c(Na+),正确的离子浓度大小为:(A-)>c(Na+)>c(HA)>c(H+),故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
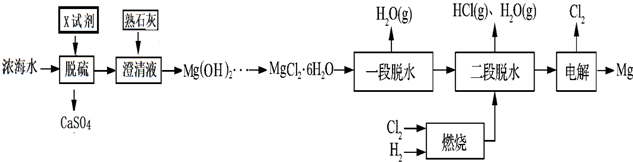
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
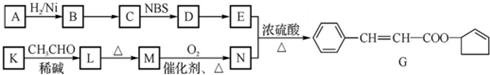
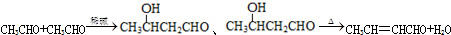
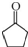 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
.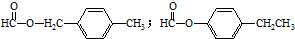 .
.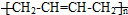 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

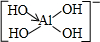 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
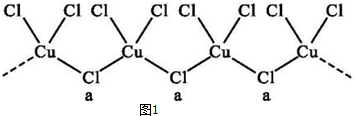
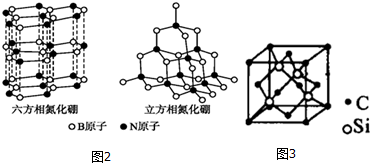
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com