
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| B. | pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中:c(Cl-)=c(I-) | |
| D. | 0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后所得溶液中:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
分析 A.常温下,pH=5的溶液中c(H+)=10-5mol/L;
B.溶液显碱性,HCO3-的水解程度大于电离程度;
C.AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-);
D.0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,溶液中溶质为CH3COOH和CH3COONa,根据物料守恒和电子守恒分析.
解答 解:A.常温下,pH=5的溶液中c(H+)=10-5mol/L,所以pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等,故A错误;
B.溶液显碱性,HCO3-的水解程度大于电离程度,所以c(H2CO3)>c(CO32-),则pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,均存在溶解平衡,溶液中Ag+浓度相同,AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-),故C错误;
D.0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,溶液中溶质为CH3COOH和CH3COONa,溶液中物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),
电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以溶液中:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确.
故选D.
点评 本题考查了离子浓度大小比较、电解质溶液中物料守恒、弱电解质电离平衡、盐类水解原理等知识点,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
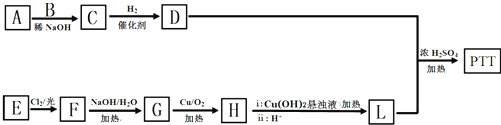
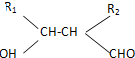
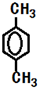 .
.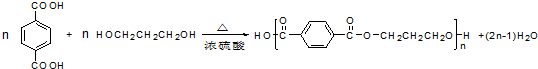 .
.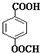 (填结构简式).
(填结构简式).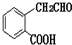 和CH3OH为有机原料制备化合物
和CH3OH为有机原料制备化合物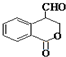 的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$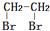 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | NaHS溶液呈碱性:HS-+H3O+?H2S+H2O | |
| C. | 4 mol•L-1的KAl(SO4)2溶液与7 mol•L-1的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-=2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O | |
| D. | 食醋清除热水瓶胆水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y都存在同素异形现象 | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com