
【题目】X、Y、Z、W、Q五种元素,原子序数均小于36,它们的核电荷数依次增加,且核外电子数之和为54。X的激发态原子电子排布式为![]() ,Y原子的基态原子
,Y原子的基态原子![]() 能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)基态Q原子价电子排布式为_____。
(2)X、Y、Z、Q电负性由大到小排序为___(写元素符号)
(3)X与Z形成的化合物![]() ,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
(4)W的氯化物和![]() 的氧化物中,熔点较高的是____(填化学式),原因是_____。
的氧化物中,熔点较高的是____(填化学式),原因是_____。
(5)由X、Y组成的一种微粒结构如图![]() ,请写出该微粒的化学式:_____。
,请写出该微粒的化学式:_____。
(6)图(a)是![]() 的拉维斯结构,
的拉维斯结构,![]() 以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为
以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为![]() ,则
,则![]() 的密度是_____
的密度是_____![]() (列出计算表达式)。
(列出计算表达式)。


【答案】![]()
![]()
![]() 平面三角形
平面三角形 ![]()
![]() 和
和![]() 都为离子晶体,
都为离子晶体,![]() 和
和![]() 半径小,电荷数大,因此
半径小,电荷数大,因此![]() 晶体的晶格能大,熔点高
晶体的晶格能大,熔点高 ![]()
![]()
【解析】
Y原子的基态原子2p上有两个未成对电子,则Y可能是C,也可能是O,根据W的电离能,推出W最外层只有1个电子,属于IA族,因为原子序数依次增大,因此Z位于第二周期,Z是同周期中未成对电子数最多,即Z为N,Y为C,基态Q原子的d轨道处于全充满状态,K层电子数为2,最外层电子数为1,即该元素为Cu,五种元素核外电子数之和为54,则X为H,据此分析;
(1)根据上述分析,Q为Cu,位于第四周期IB族,价电子包括最外层电子和次外层的d能级上的电子,即价电子排布式为3d104s1;
答案为3d104s1;
(2)一般非金属性越强,电负性越大,因此顺序是N>C>H>Cu;
答案为N>C>H>Cu;
(3)该化合物为N2H4,N2H4的电子式为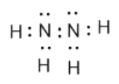 ,因此N的杂化类型为sp3,Z的最高价氧化物的水化物的正盐的阴离子是NO3-,其中N有3个σ键,孤电子对数为
,因此N的杂化类型为sp3,Z的最高价氧化物的水化物的正盐的阴离子是NO3-,其中N有3个σ键,孤电子对数为![]() =0,价层电子对数为3,即NO3-空间构型为平面三角形;
=0,价层电子对数为3,即NO3-空间构型为平面三角形;
答案为sp3;平面三角形;
(4)W的氯化物是NaCl,Mg的氧化物是MgO,两者都属于离子化合物,离子晶体的熔点与晶格能有关,离子半径越大、所带电荷数越大,晶格能越高,熔点越高,Mg2+、O2-的半径分别小于Na+、Cl-,且Mg2+、O2-所带电荷数大于Na+、Cl-,MgO晶格能大于NaCl,即MgO的熔点高于NaCl;
答案为MgO;NaCl、MgO都为离子晶体,Mg2+和O2-半径小,电荷数大,因此MgO晶体的晶格能大,熔点高;
(5)C、H组成一种微粒,结合该微粒的球棍模型,C的半径大于H,即该微粒的化学式为CH3-;
答案为CH3-;
(6)MgQ2的化学式为MgCu2,根据晶胞的结构,Mg位于8个顶点、6个面心上,在晶胞内部有4个Mg原子,Mg原子个数为![]() =8,则Cu的个数为16个,晶胞的质量为
=8,则Cu的个数为16个,晶胞的质量为![]() g,晶胞的体积为(a×10-10)3cm3,根据密度的定义得出晶胞的密度是
g,晶胞的体积为(a×10-10)3cm3,根据密度的定义得出晶胞的密度是![]() g/cm3;
g/cm3;
答案为![]() 。
。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】测定 0.1 mol/LNa2SO3溶液先升温再降温过程中的 pH ,数据如下。

实验过程中,取①、④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是( )
A. 此实验中 Na2SO3溶液的 pH 是由 pH 计测定的
B. ④与①的 PH 不同,是由于 SO32—浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的 KW值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与“物质的量”相关的计算正确的是
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
B.28 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
其中铜、硒、碲的主要回收流程如图:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低![]() ,
,![]() 及碳氧化合物的排放。以
及碳氧化合物的排放。以![]() 为例,已知:
为例,已知:
①![]()
②![]()
③![]()
④![]()
①②③④反应热效应之间的关系式为![]() ___;有利于提高④
___;有利于提高④![]() 转化率的反应条件是___。
转化率的反应条件是___。
(2)研究发现,将煤炭在![]() 的气氛下燃烧,能够降低燃煤时
的气氛下燃烧,能够降低燃煤时![]() 的排放,主要反应为:
的排放,主要反应为:![]() 。
。
①该反应的平衡常数表达式为____。
②在密闭容器中发生该反应时,![]() 随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的
随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的![]() ___0(填“>”或“<”),在
___0(填“>”或“<”),在![]() 温度下,
温度下,![]() 内
内![]() 的平均反应速率
的平均反应速率![]() ___。
___。
③将![]() 和
和![]() 充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
A.升高温度 B.加入![]() C.加催化剂 D.降低温度
C.加催化剂 D.降低温度


④将上述反应产生的![]() 与
与![]() 为原料合成尿素,能够实现节能减排:
为原料合成尿素,能够实现节能减排:
Ⅰ:![]() Ⅱ:
Ⅱ:![]()
将一定量的![]() 固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时
固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时![]() ,
,![]() 为
为![]() ,若反应温度不变,将体系的体积增加50%,一段时间后
,若反应温度不变,将体系的体积增加50%,一段时间后![]() 的取值范围是____(用含a的式子表示)。
的取值范围是____(用含a的式子表示)。
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。![]() 及
及![]() 均是性能优良的脱硫脱硝试剂。
均是性能优良的脱硫脱硝试剂。
①![]() 在酸性条件下稳定,在
在酸性条件下稳定,在![]() 溶液中可歧化为
溶液中可歧化为![]() 和
和![]() ,该反应的化学方程式为___。
,该反应的化学方程式为___。
②某研究小组用![]() 进行单独脱除
进行单独脱除![]() 实验时,测得
实验时,测得![]() 的脱除率随溶液
的脱除率随溶液![]() 变化如图所示。当
变化如图所示。当![]() 时,随
时,随![]() 的增大,
的增大,![]() 脱除率逐渐降低,其原因是____。
脱除率逐渐降低,其原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,如图是它的一种合成路线(具体反应条件和部分试剂略)

已知:
①氯化亚砜![]() 可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② +X2
+X2 +HX(X表示卤素原子)
+HX(X表示卤素原子)
③![]()
回答下列问题:
(1)F中所含的官能团名称是_______。
(2)![]() 的反应类型是______。
的反应类型是______。
(3)写出F和C在浓硫酸条件下反应的化学方程式______。
(4)写出A的符合以下条件同分异构体的所有结构简式_______。
①属于苯的二取代物; ②苯环上的一氯代物有2种; ③与![]() 溶液发生显色反应。
溶液发生显色反应。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线,并注明反应条件____。
)写出合成路线,并注明反应条件____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇 在化学反应中断键位置说法错误的是 ( )
在化学反应中断键位置说法错误的是 ( )
A. 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。
B. 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。
C. 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应。
D. 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com