
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
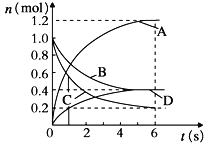
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
【答案】C
【解析】
试题分析:由图可知,反应达到平衡时A物质增加了1.0mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,B、C为反应物,A、B、C、D物质的量之比为5:3:4:2,反应方程式为:3B+4C5A+2D,故A错误;反应到1s时,v(A)= =0.3mol/(Ls),v(D)=
=0.3mol/(Ls),v(D)= =0.1mol/(Ls),所以v(A)≠v(D),故B错误;反应进行到6s时,△n(B)=1mol-0.4mol=0.6mol,v(B)=
=0.1mol/(Ls),所以v(A)≠v(D),故B错误;反应进行到6s时,△n(B)=1mol-0.4mol=0.6mol,v(B)= =0.05mol/(Ls),故C正确;根据图象可知,到6s时各物质的物质的量不再改变了,达到平衡状态,所以各物质的浓度不再变化,但是由于各物质的化学计量数不相同,则各物质的反应速率不相等,故D错误;
=0.05mol/(Ls),故C正确;根据图象可知,到6s时各物质的物质的量不再改变了,达到平衡状态,所以各物质的浓度不再变化,但是由于各物质的化学计量数不相同,则各物质的反应速率不相等,故D错误;


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
被提纯物质 | 除杂试剂 | 分离方法 | |
A | 淀粉(NaCl) | H2O | 渗析 |
B | Al2O3(SiO2) | NaOH溶液 | 过滤 |
C | CO2(CO) | O2 | 点燃 |
D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.稀硫酸滴在银片上:2Ag+2H+===2Ag++H2↑
B.稀硫酸与氢氧化钡溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞的结构和生命活动的物质基础是构成细胞的各种化合物,下列有关这些化合物功能的叙述,正确的是
A. 生命活动都由蛋白质调节
B. 干种子因缺乏自由水不能萌发
C. 多糖是植物细胞的能源物质
D. 生物的遗传物质是DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 大米富含淀粉
B. 加碘食盐含有碘酸钾(KIO3)
C. 人体必需的微量元素就是维生素
D. 人体必需的微量元素不都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图).

(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:
④_________,⑤_________,⑥_________;
(2)写出第⑤步操作中可能发生反应的化学方程式:________________________;
(3)如何用最简单方法检验第⑤步实验是否达到了目的:________________________;
(4)你认为该设计里哪些步骤调换后不影响实验结果:____________________________;
(5)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应。
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 与 ΔH1、ΔH2 之间的关系是:ΔH3=________。
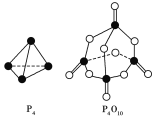
(2)白磷与氧气反应生成P4O10 固体 。下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | P===O | O===O |
键能/kJ·mol-1 | a | b | c | d |
根据右图的分子结构和有关数据通过计算写出该反应的热化学方程式为 。
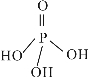
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如右下图)之间脱去两个水分子产物,其结构式为_________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(4)已知298 K时白磷不完全燃烧的热化学方程式为:
P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1 638 kJ·mol-1。
在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下微粒:①N2H4 ②P4 ③H2O ④N2 ⑤H3O+ ⑥NH4+ ⑦CO2 ⑧H2O2
(填编号)
(1)既有极性键又有非极性键的是 ;(2)既有σ键又有π键的是 ;
(3)微粒中不含孤电子对的是____________;(4)立体构型呈正四面体的是____________;
(5)⑤和⑧的电子式分别为 和 ;
(6)⑥和⑦的结构式分别为 和 ;
(二)以下反应均为放热反应,根据热化学方程式,比较 △H1 和 △H2 的大小
① I2(g)+ H2(g)=2HI(g) △H1;I2(s)+ H2(g)=2HI(g) △H2,则△H1 △H2
② H2(g)+Cl2(g)=2HCl(g) △H1;H2(g)+Br2(g)=2HBr(g) △H2,则△H1 △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)标准状况下,2.4g某气体的体枳为672mL,则此气体的相对分子质量为__________。
(3)某盐混合溶液中含有离子:Na+、Mg2+、 Cl-、SO42-,测得Na+、Mg2+和C1-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,测得c(SO42-)=__________。
(4)己知离子反应:RO33-+6I-+6H+=R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=___________,R元素在中RO33-的化合价是_____________。
(5)同温同压下,SO2与O2的密度之比为___________,若质量相同,两种气体的体积比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com