



 其相关数据如下表所示:
其相关数据如下表所示:

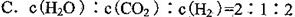



科目:高中化学 来源:不详 题型:填空题

| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Sn(白,s)ΔH3=+2.1 kJ·mol-1
Sn(白,s)ΔH3=+2.1 kJ·mol-1| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H
H H,则
H,则 H= ;
H= ;
 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


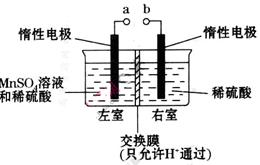
 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 共价键 | H—N | H—O | N≡N | O=O |
| 断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com