
����Ŀ���ش����и��⣺
��1����H2��H2����H2O��H2O����CH3OH��H2O����CCl4��H2O���������Է���֮��ֻ���ڷ��»������� �� �������������(�����)
��2�������ʢٱ�����NH3����C3H8����  ���ݶ��ǻ�����ȩ����CH3CH2OH�У����γɷ��Ӽ�������� �� ���γɷ������������ �� �����γ����������(�����)
���ݶ��ǻ�����ȩ����CH3CH2OH�У����γɷ��Ӽ�������� �� ���γɷ������������ �� �����γ����������(�����)
��3���ھ����NaCl���ڸɱ����۽��ʯ���ܽ������У��乹����֮����������ֱ����������������۵���ߵ��� �� ��͵���(�����)��
��4�����ڻ�ʱ��Ҫ�˷�H2O���Ӽ�������������CS2ʱ��������֮������á�
��5����NCl3��PCl3��AsCl3��SbCl3�зе���͵�������KF��KCl��KBr��KI�У��۵���ߵ�����
���𰸡�
��1���٢ܣ��ڢ�
��2���ڢݢޣ��ܣ��٢�
��3�����Ӽ������»��������ۼ������������ۣ���
��4�����»�������������»���
��5��NCl3��KF
��������(1)��������γɵ�������X��H��Y��X��Y����Ϊ�縺�Դ�ķǽ�������N��O��F����Y��Ӧ�йµ��Ӷԣ��ɴ˿����жϢڢۿ����γ������(2)��(1)�ⷨ���ơ�(3)����������Ϊ���Ӿ��塢���Ӿ��塢ԭ�Ӿ��塢�������壬Ȼ���ж�����������ǿ�������ݸ��������ʣ��۵���ߵ�һ��Ϊԭ�Ӿ��壻��͵�һ��Ϊ���Ӿ��塣(4)H2O�д���������ʱ��ڻ���˷����»����������S����CS2�������»�����(5)�ṹ��������Ƶķ����ڲ��������ʱ����Է�������Խ�е�Խ�ߣ���NCl3�е���͡����Ӿ����У�������(���Ľڻ�ѧ��)Խ�е�Խ�ߣ���뾶F��<Cl��<Br��<I�� �� ��K�����ʱ��K����F��֮�侧�������KF�۵���ߡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1�������Լ�ƿ��ʢװ������ͬ��Ũ�����Ũ���ᣬ�ֱڷ���һ��ʱ�������Һ������ϵΪm�����ᣩ m�����ᣩ���>������<����=����������Ũ�����Ũ���ᶼ����ǿ�����ԣ��������Ũ�����Ũ���ᶼ��������д�������ƣ�������ʢ�š�
��2���Ʊ�CuSO4��Cu(NO3)2
�������������Ʊ�Cu(NO3)2��;�����������;���ǣ�ѡ����ĸ��
a. Cu ![]() Cu(NO3)2
Cu(NO3)2
b. Cu ![]() Cu(NO3)2
Cu(NO3)2
c. Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
d. Cu ![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
�� ��ϡ������Һ�м���ͭ�ۣ�Ȼ��ͨ���ȿ��������Ƶ�����ͭ��Һ��������Ӧ�����ӷ���ʽΪ��
��3����200mL2mol/LHNO3��Һ�м�������ͭ�ۣ�������ú���m1g���岻������� ����100mL 1mol/L������Һ��������ú���m2g���岻����� m1 m2���>������<����=�����������������g����������ȣ�����ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���֤��SiO2���������������( )
��SiO2+4HF=SiF4��+2H2O ��SiO2+CaO ![]() CaSiO3
CaSiO3
��SiO2+2NaOH=Na2SiO3+H2O ��SiO2+2C ![]() Si+2CO��
Si+2CO��
A.�٢�
B.�ڢ�
C.�ۢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������P��P���Ͽ�����һ��������  �е�ÿ��P��P�����Ͽ�����һ����ԭ�ӣ���һ���ɽ������ԭ�ӣ������õ���һ������������ʽΪ����C��H��N����Ԫ����ɵ�ij�����������ں�4����ԭ���ų��ڿյ���������(ͬ����)��ÿ������ԭ�Ӽ䶼��һ��̼ԭ�ӣ��ҷ�������C��C��C=C������ķ���ʽ��
�е�ÿ��P��P�����Ͽ�����һ����ԭ�ӣ���һ���ɽ������ԭ�ӣ������õ���һ������������ʽΪ����C��H��N����Ԫ����ɵ�ij�����������ں�4����ԭ���ų��ڿյ���������(ͬ����)��ÿ������ԭ�Ӽ䶼��һ��̼ԭ�ӣ��ҷ�������C��C��C=C������ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������һ��������һ����C3H7��һ����OH���������ڷ���Ľṹ������
A.3��B.4��C.5��D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��ϡH2SO4��Ӧ��ȡ���������д�ʩһ����ʹ�������������ʼӿ���ǣ� ��
A.����������
B.���������Ũ��
C.����
D.����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����298K��101.325kPaʱ�������з�Ӧ�� ��2H2��g��+O2��g���T2H2O��l����
��CaO��s��+CO2��g���TCaCO3��s����
���ر�ֱ�Ϊ��S1�͡�S2 �� �������������ȷ���ǣ� ��
A.��S1��0����S2��0
B.��S1��0����S2��0
C.��S1��0����S2��0
D.��S1��0����S2��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϵͳ��������ȷ����( )
A. 2-��-4-�һ�����B. 2-��-3-��Ȳ
C. 2,3-���һ�-1-��ϩD. 2,3-������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þƬ����Ƭƽ�в��뵽һ��Ũ�ȵ�NaOH��Һ�У��õ������ӳɱպϻ�·����װ���ڹ���ʱ������������ȷ���ǣ� �� 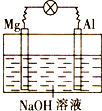
A.þ�������ã�þʧȥ���ӱ�������Mg2+
B.���ǵ�ظ�������ʼ����ʱ��Һ�л������а�ɫ��������
C.��װ�õ��ڡ����·�У����ǵ��ӵĶ����ƶ��γɵ���
D.��װ�ÿ�ʼ����ʱ����Ƭ���������Ĥ�ɲ��ش���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com