
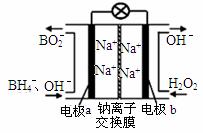
 (1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价)和H2O2作原料的燃料电池,可用作通信卫星电。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:
▲ 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。
已知: N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H = – 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H = – 98.6 kJ·mol—1
写出常温下,N2H4(l) 与 H2O2(l)反应生成N2和H2O的热化学方程式 ▲ 。
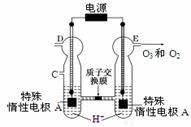 (3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
(3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为 ▲ (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: ▲
(4)向一密闭容器中充入一定量一氧化碳跟水蒸气发生反应 CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ ▲ _____(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是____ ▲ _____(选填编号)。
A.v正(H2O) = v逆(H2)
B.容器中气体的压强不再发生改变
C.H2O的体积分数不再改变
D.容器中CO2和H2的物质的量之比不再发生改变
E.容器中气体的密度不再发生改变
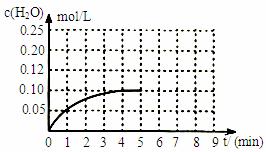 (5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g)
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化趋势的曲线。
科目:高中化学 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1 |
| K2=5.6×10-11 mol·L-1 |
A.[HCO ]>[ClO-]>[OH-]
]>[ClO-]>[OH-]
B.[ClO-]>[HCO ]>[H+]
]>[H+]
C.[HClO]+[ClO-]=[HCO ]+[H2CO3]
]+[H2CO3]
D.[Na+]+[H+]=[HCO ]+[ClO-]+[OH-]
]+[ClO-]+[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)2SO3(g) ΔH<0的实验数据如下表:
| 温度 | 不同压强下SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)应选择的温度是________。
(2)应采用的压强是________,理由是
________________________________________________________________________________________________________________________________________________。
(3)在合成SO3的过程中,不需要分离出SO3的原因是________________________________________________________________________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
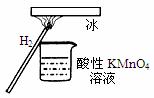
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电 场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实均能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH比0.1 mol/L盐酸的pH大 ⑤醋酸能和碳酸钙反应放出CO2 ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢
A.②③⑥ B.④⑤⑥ C.③④⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32 -)>c(HCO3- )>c(OH-)
B.20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-) >c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-)
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是________,实例:________。
(2)只能做还原剂的是________,实例:________。
(3)H2O作为氧化剂的反应实例:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com