
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | ||
| ② | 加入少量Na2O2粉末 | ||
| ③ | 加入少量AgNO3溶液 |
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | 铁粉部分溶解,溶液由棕黄色变浅绿色 | 2Fe3++Fe=3Fe2+ |
| ② | 加入少量Na2O2粉末 | 反应生成红褐色沉淀放出气体 | 2Na2O2+2H2O=4Na++4OH-+O2↑ Fe3++3OH-=Fe(OH)3↓ |
| ③ | 加入少量AgNO3溶液 | 产生白色沉淀 | Ag++Cl-=AgCl↓ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、用氨水清洗试管内壁附着的银镜 |
| B、用饱和Na2CO3溶液除去乙醇中少量的乙酸和水 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
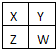 已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )| A、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸 |
| B、若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) |
| C、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱 |
| D、若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在碱性溶液中:HCO3-、K+、C1-、Na+ |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42- |
| C、在c(H+)/c(OH-)═1×1013的溶液中:NH4+、Br-、C1-、K+ |
| D、通有SO2的溶液中:Ca2+、C1-、NO3-、A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实 验 操 作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤 | 得到白色晶体 | 白色晶体为KNO3 |
| C | 向某FeCl2溶液中,加入Na2O2粉末 | 得红褐色沉淀 | 原FeCl2已氧化变质 |
| D | 向浓度均为0.1mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
科目:高中化学 来源: 题型:
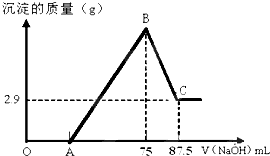 将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:
将一定量镁和铝的混合粉末加入50mL未知浓度的硫酸中,搅拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的体积与产生沉淀的量如下图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com