
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、放出热量关系:a=92.4<b |
| B、N2的转化率:③>①>② |
| C、达平衡时氨气的体积分数:①>③ |
| D、三个容器内反应的平衡常数:③>①>② |


科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH-用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+3H+明矾净水 |
| C、TiCl4+(x+2)H2O(过量)═TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O═Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,含有2mol硫酸的浓硫酸与足量的Zn反应,转移的电子数为4NA |
| B、室温下,4.4g乙醛、乙酸乙酯的混合物含有碳原子数为0.2NA |
| C、1.0L1.0mol?L-1Na2CO3溶液中含有的氧原子数为3NA |
| D、在SiO2晶体中1molSi形成的Si-O键为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用激光笔检验淀粉溶液的丁达尔现象 |
| B、在容量瓶中加一定体积的水,再加入氢氧化钠晶体配制准确浓度的氢氧化钠溶液 |
| C、加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 |
| D、用食醋除去暖瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐酸或NH4Cl溶液可溶解Mg(OH)2沉淀 |
| B、可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 |
| C、附着在试管内壁上的AgCl固体可用氨水溶解而洗去 |
| D、除干燥CO2中混有的少量SO2可将混合气体通过盛有酸性KMnO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用①装置可以在实验室中制取乙炔 |
| B、图②是构成铜锌原电池的原理示意图 |
| C、图③是配制溶液中的转移溶液 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
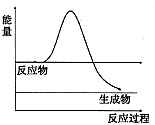
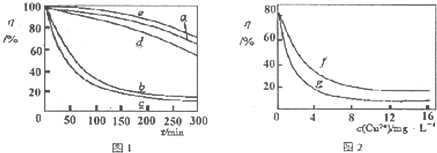
| ||
| ||
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com