
| A. | ①②⑥ | B. | ②③④ | C. | ④⑤⑥ | D. | ②③⑦ |
分析 ①分子晶体的熔、沸点与分子间作用力有关,与共价键无关;
②含有金属阳离子的晶体是离子晶体或金属晶体;
③根据晶体和非晶体中微粒的排列特点分析;
④离子所带的电荷越多,离子半径越小,离子晶体的晶格能越大;
⑤根据晶胞概念分析;
⑥CsCl晶体中配位数为8;
⑦晶体多采用紧密堆积方式.
解答 解:①分子晶体的熔、沸点与分子间作用力有关,与共价键无关,故①错误;
②含有金属阳离子的晶体是离子晶体或金属晶体,金属晶体是金属阳离子和自由电子构成的,故②错误;
③晶体中粒子在三维空间里呈周期性有序排列,有自范性,而非晶体中原子排列相对无序,无自范性,故③正确;
④MgO和NaCl两种晶体中,半径:Mg2+<Na+、O2-<Cl-,则MgO的晶格能较大,所以其熔点比较高,故④正确;
⑤晶胞是描述晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;
⑥干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,CsCl晶体中配位数为8,NaCl晶体配位数为6,故⑥错误;
⑦晶体多采用紧密堆积方式,采取紧密堆积方式,可以使晶体变得比较稳定,故⑦正确;
故选A.
点评 本题考查了晶体好非晶体的区别、晶体的构成、晶胞的概念、配位数的判断等,题目涉及的知识点较多,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
 (I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
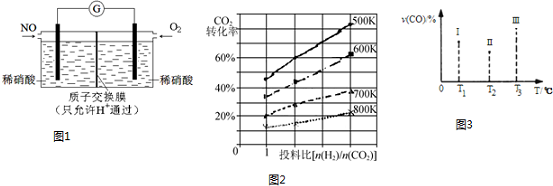
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和锂同一主族的都是金属元素 | B. | LiOH的碱性比NaOH的弱 | ||
| C. | 锂的化学性质不如钠活泼 | D. | Li在空气中燃烧生成Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
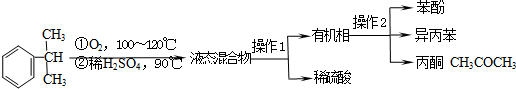
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水 和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机 杂质的试剂是①A.(填写右边字母) | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯 酚的方案: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液,若试管中溶液颜色变为②紫色,则丙酮中含有苯酚,反之则没有. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是铜,负极的电极反应式是Cu-2e-═Cu2+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com