
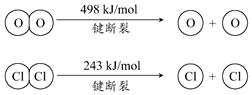
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:
用Cl2生产某些含氯有机物时会产生副产物HCl.利用如下反应,可实现氯的循环利用:| A. | 升高温度能提高HCl的转化率 | |
| B. | 加入催化剂,能使该反运的焓变减小 | |
| C. | 1molCl2转化为2molCl原子放出243kJ热量 | |
| D. | 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高 |
分析 A.升高温度,平衡向吸热方向移动;
B.催化剂降低反应的活化能,对焓变无影响;
C.断键要吸收能量;
D.反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而判断键能大小.
解答 解:A.该反应的正方向为放热方向,升高温度,平衡向吸热方向移动,即向逆方向移动,HCl的转化率减小,故A错误;
B.催化剂降低反应的活化能,对焓变无影响,所以加入催化剂,该反应的焓变保持不变,故B错误;
C.断键要吸收能量,则1molCl2转化为2molCl原子吸收243kJ热量,故C错误;
D.E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
即断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高,故D正确.
故选D.
点评 本题考查反应热与焓变,为高频考点,把握能量变化与反应的关系、影响化学平衡和焓变的因素为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
| A. | ①⑤ | B. | ①②④⑥ | C. | ①④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓氨水中加固体NaOH | B. | 混合NH4Cl溶液和NaOH溶液 | ||
| C. | 加热分解NH4Cl晶体 | D. | 加热消石灰和NH4NO3的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、氯化钠、氨气、干冰 | B. | 碳酸、氯化钠、乙酸、冰 | ||
| C. | 草酸、碳酸氢钠、氯化钠、碳酸钙 | D. | 硫酸、硫酸钡、醋酸铵、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com