
| A. | 与水反应时,比钠更剧烈 | B. | 它的原子半径比钠的小 | ||
| C. | 它是密度最小的碱金属 | D. | 它可以做还原剂 |
分析 A、锂的金属性比钠弱;
B、钠的电子层数比锂的电子层数多;
C、碱金属从上到下单质的熔点降低,密度增大;
D、最外层只有一个电子,易失电子.
解答 解:A、锂的金属性比钠弱,所以与水反应时,钠比锂更剧烈,故A错误;
B、钠的电子层数比锂的电子层数多,电子层数越多半径越大,所以它的原子半径比钠的小,故B正确;
C、碱金属从上到下单质的熔点降低,密度增大,所以它是密度最小的碱金属,故C正确;
D、最外层只有一个电子,易失电子,所以它可以做还原剂,故D正确;
故选A.
点评 本题考查碱金属的性质,把握碱金属性质的递变规律为解答的关键,注意原子结构决定性质,明确元素周期律的应用,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液:Na+、Ba2+、AlO2-、Cl- | |
| B. | 由水电离得到的c(H+)=1×10-12的溶液中:K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:$NH_4^+$、Al3+、$NO_3^-$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2=2Z | B. | 2X2+2Y2=2Z | C. | 3X2+Y2=2Z | D. | X2+3Y2=2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 实验室常采用铁屑、溴水、苯混合制溴苯 | |
| C. | 苯中含有少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| D. | 一定物质的量浓度溶液的配置必须要用干燥的容量瓶,否则有误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
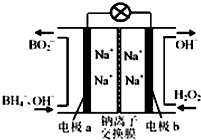 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极a采用MnO2,放电时它被还原 | |
| C. | 该电池负极的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 放电时,a极区的电极反应生成碱,碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
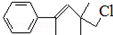 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 该分子中能通过聚合反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com