
| A. | Na+、Cl-、Al3+、Ag+ | B. | $NH_4^+$、Mg2+、$NO_3^-$、$SO_4^{2-}$ | ||
| C. | K+、Ca2+、$NO_3^-$、$CO_3^{2-}$ | D. | $HCO_3^-$、Na+、K+、$SO_4^{2-}$ |
分析 强酸性溶液中存在大量氢离子,
A.氯离子与银离子反应生成难溶物氯化银;
B.四种离子之间不反应,都不与氢离子反应;
C.碳酸根离子与钙离子、氢离子反应;
D.碳酸氢根离子与氢离子反应.
解答 解:A.Cl-、Ag+之间反应生成氯化银沉淀,在溶液中不能大量共存,故A错误;
B.NH4+、Mg2+、SO42-、NO3-之间不反应,都与不与强酸性溶液中的氢离子反应,在溶液中能够大量共存,故B正确;
C.Ca2+与CO32-生成沉淀,CO32-与强酸性溶液反应生成二氧化碳气体,在溶液中不能大量共存,故C错误;
D.HCO3-与强酸性溶液中的氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$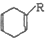
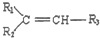 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$ +R3-COOH
+R3-COOH ,D的核磁共振氢谱共有3组峰.
,D的核磁共振氢谱共有3组峰.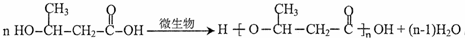 .
. (一种类似有机玻璃的塑料).第一步反应的化学方程式是
(一种类似有机玻璃的塑料).第一步反应的化学方程式是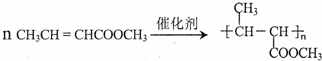 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
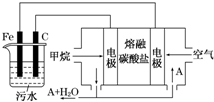 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(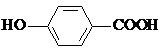 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
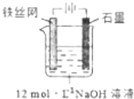 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com