
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
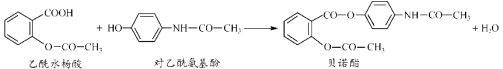
下列有关叙述正确的是
A.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
B.贝诺酯分子中有三种含氧官能团
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:

(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为_____________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入______________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为__________________________。
(5)写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL H2、C2H6和CO2的混合气体与300 mL O2混合点燃,经充分反应并干燥后,总体积减少100 mL。再将剩余气体通过碱石灰吸收,体积又减少100 mL。上述体积均在同温同压下测定。求原混合气体中各组分的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:

有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。
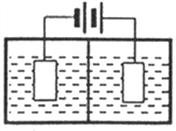
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如右图所示装置。试回答下列问题:
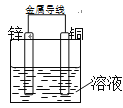
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的______极(填“正”或“负”),发生_______反应(填“氧化”或“还原”), 电极反应式为___________________;Cu棒上可观察到的现象是______________________,电极反应式为______________________________。
(2)若电解质为硫酸铜溶液,则Cu棒为原电池的______极(填“正”或“负”),发生_________反应(填“氧化”或“还原”),其电极反应式为____________________________________。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 1L 0.10 mol·L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是
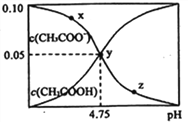
A. 溶液的pH比较:x<y <z
B. 在y点再通入0.05 mol HCl气体,溶液中离子浓度大小比较:c(Na+) =c(Cl-) > c(H+) >c(CH3COO-) >c(OH-)
C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点
D. 该温度下,CH3COOH的Ka=104.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
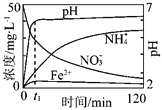
(1)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是_________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式)。
(2)图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 _____________ 。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三
假设一:溶液的pH;假设二:__________________; 假设三:__________________;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO![]() 浓度可用离子色谱仪测定)__________________
浓度可用离子色谱仪测定)__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
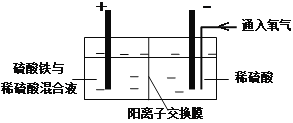
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com