
【题目】废水中氨氮(NH3、NH![]() )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
(1) 氨氮污水直接排放入河流、湖泊导致的环境问题是________。
(2) 生物脱氮法:利用微生物脱氮,原理如下:
NH![]()
![]() NO
NO![]()
![]() N2
N2
反应①的离子方程式为__________________________________。
(3) 化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,NH![]() 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
(4) 折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O===HClO+NaOH(Ⅰ)
NH3+HClO===NH2Cl+H2O(Ⅱ)
NH2Cl+HClO===NHCl2+H2O(Ⅲ)
NHCl2+H2O===NOH+2HCl(Ⅳ)
NHCl2+NOH===N2↑+HClO+HCl(Ⅴ)
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
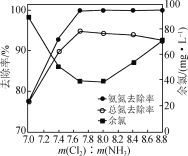
①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是__________________。
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是____________________________。
(5) 电催化氧化法:原理如下图所示(MOx表示催化剂)。反应Ⅱ的离子方程式可表示为2NH4++6MOx(·OH)===6MOx+N2↑+6H2O+2H+。

①阳极电极反应式Ⅰ为________________________________。
②电催化氧化法除氨氮时,若其他条件相同时,含Cl-的污水比不含Cl-的污水氨氮去除率要高,其原因是________________________________。
【答案】水体富营养化 NH4++2O2![]() NO3-+2H++H2O MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O 次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3- 加入次氯酸钠量不足,部分氨氮以NH2Cl形式存在 MOx+H2O-e-===MOx(·OH)+H+ Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去
NO3-+2H++H2O MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O 次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3- 加入次氯酸钠量不足,部分氨氮以NH2Cl形式存在 MOx+H2O-e-===MOx(·OH)+H+ Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去
【解析】
(1)水体中N、P等营养盐含量过多而引起的水质污染,导致水体富营养化;
(2)铵根与氧气在硝化细菌的作用下生成硝酸根离子和水;
(3)沉淀会溶解在过量的碱性环境中;
(4)①次氯酸钠氧化性较强,若投入量过大,则部分N元素会被氧化为硝酸根离子;
②次氯酸钠投入量过少,发生次氯酸会将氨气按反应Ⅱ氧化为NH2Cl;
(5)①依据电解原理,阳极发生失电子的氧化反应,据此分析;
②根据放电顺序,电解质溶液中有氯离子的话氯离子先放电,氯气溶于水形成的次氯酸参与氨氮的去除反应。
(1)氨氮污水直接排放入河流、湖泊导致水体富营养化;
(2)根据图示信息可知,反应①的离子方程式为NH4++2O2![]() NO3-+2H++H2O;
NO3-+2H++H2O;
(3)若pH过大,MgNH4PO4·6H2O会与氢氧根离子反应转化成氢氧化镁,其离子方程式为:MgNH4PO4·6H2O+2OH-===Mg(OH)2+NH4++PO43-+6H2O;
(4)①当m(Cl2)∶m(NH3)≥7.7时,次氯酸钠投加量过大,导致污水中部分氨氮氧化为NO3-;
②当m(Cl2)∶m(NH3)<7.7时,说明次氯酸投入量小,此时部分氨氮以NH2Cl形式存在;
(5)①依据电解原理,阳极MOx失电子转化为MOx(·OH),其电极反应式为:MOx+H2O-e-===MOx(·OH)+H+;
②电催化氧化法除氨氮时,若其他条件相同时,污水若有Cl-在阳极放电生成Cl2,Cl2将氨氮氧化为N2而除去,因此含Cl-的污水比不含Cl-的污水氨氮去除率要高。


科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是

A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A.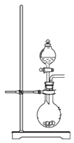 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B. 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C. 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D. 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验符合操作要求且能达到实验目的的是( )
A.I可用于制备氢气并检验其可燃性
B.II可用于除去CO2中的HCl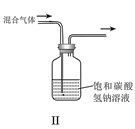
C.Ⅲ可用于配制一定物质的量浓度的NaOH溶液
D.IV可用于制备氢氧化亚铁并长时间保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C12H16O2)具有芳香气味,常用作芳香剂。

已知:①B属于芳香族化合物且结构中只有一个侧链,分子式为C8Hl0O;
②D、E具有相同官能团,核磁共振氢谱测得E分子中有3种不同的峰。
回答下列问题:
(1)C可能发生的反应有___(填序号)。
①取代反应②消去反应③水解反应④加成反应
(2)与D属于同系物的同分异构体有___种(不包括D)。
(3)B发生消去反应所得有机物的结构简式为_____。
(4)B和E反应生成A的化学方程式为_______。
(5)C生成D的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )
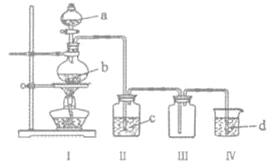
Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有KOH标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B→__→__→__→__→F。
(2)上述(B)操作的目的是___。
(3)判断滴定到达终点的现象是___。
(4)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为__mL,终点读数为___mL;所测盐酸溶液的浓度为___mol/L。
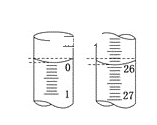
(5)若滴定终点读数时,俯视滴定管的刻度,其他操作均正确,则对滴定结果产生的影响是__。若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___。(填“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com