
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
分析 A.容量瓶有瓶塞,使用前需要检查是否漏水;
B.不能用待测液润洗容量瓶,否则配制的溶液中溶质的物质的量偏大;
C.根据摇匀容量瓶的操作方法偏大;
D.容量瓶是用于配制一定物质的量浓度的溶液的仪器,不能长期盛放溶液.
解答 解:A.容量瓶有瓶塞,若漏水会影响配制结果,所以使用前需要检查容量瓶是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,不能用待测液润洗,否则会影响配制结果,故B错误;
C.为了使溶液均匀,正确操作方法为:盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次,该操作方法合理,故C正确;
D.盛放溶液应该选用相应的试剂瓶,容量瓶不能长期存放配制好的溶液,故D正确;
故选B.
点评 本题考查了容量瓶的使用方法,题目难度不大,明确配制一定物质的量浓度的溶液方法为解答关键,注意掌握容量瓶的构造及使用方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
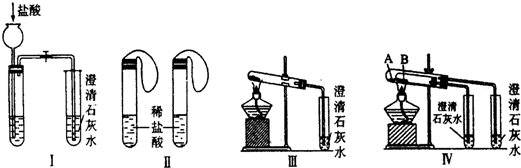
 某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
某实验学习小组用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
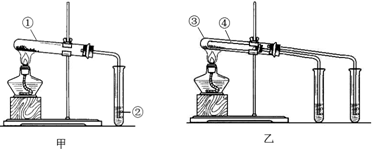
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: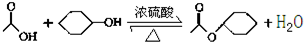
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸、空气、小苏打、乙醇 | B. | 生石灰、漂白粉、铁、二氧化硫 | ||
| C. | 明矾、盐酸、碳酸钙、氯气 | D. | 冰水混合物、氨水、纯碱、干冰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com