
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛,在锂离子电池的制备中有重要的作用。用软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。
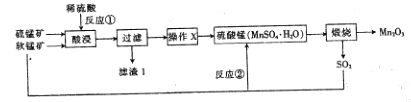
(1)反应①中会生成一种非金属单质,则该非金属单质是_________________,该反应的还原剂是________________。(填化学式)
(2)操作X为蒸发浓缩、__________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,主要目的是________________;
(3)Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为_____________;
【答案】(1)S MnS (2)冷却结晶 MnSO4·H2O在酒精中溶解度小,可减小MnSO4·H2O的损失
(3)Mn2O3+6H++2Cl-![]() 2Mn2++Cl2↑+3H2O
2Mn2++Cl2↑+3H2O
【解析】
试题分析:(1)反应①中是利用稀硫酸溶解MnO2和MnS的混合物得到MnSO4,反应中+4价Mn发生还原反应,同时S2-发生氧化反应生成S,发生反应的离子方程式为MnO2+MnS+4H+=2Mn2++S↓+2H2O;故所得非金属单质为S,反应中的还原剂是MnS;
(2)操作X的目的是从MnSO4溶液里获得MnSO4·H2O晶体,具体操作是蒸发浓缩、冷却结晶、过滤、洗涤烘干。因MnSO4·H2O在酒精中溶解度小,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,可减小MnSO4·H2O的损失;
(3)加热时Mn2O3与浓盐酸反应放出Cl2的同时生成MnCl2和H2O,该反应的离子方程式为Mn2O3+6H++2Cl-![]() 2Mn2++Cl2↑+3H2O;
2Mn2++Cl2↑+3H2O;


科目:高中化学 来源: 题型:
【题目】氢化阿托醛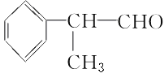 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
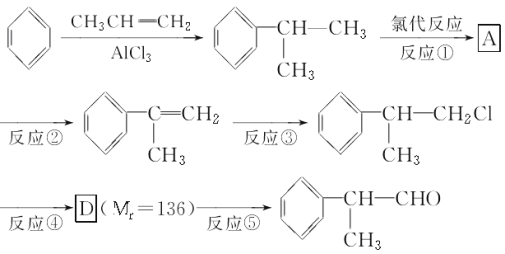
(1)在合成路线上①~⑤反应中,属于消去反应的为________(填反应序号)。
(2)写出反应③、④的化学方程式:
________________________________________________________________________;
________________________________________________________________________。
(3)在一定条件下,D与有机物X发生酯化反应生成E(Mr=164),则X的结构简式为________________________________________________________________________,写出满足下述两个条件的E的两种同分异构体的结构简式:___________________。
a.属于羧酸 b.苯环上的一氯取代物只有一种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等。
乙炔法:![]()
丙烯氨氧化法:![]()
(1)下列说法正确的是 (不定项选择):
a.NH4+空间构型呈正四面体
b.CH2=CHCN分子中只有碳、氢原子位于同一平面
c.C2H2、HCN分子中所有原子均位于同一直线
d.NH3极易溶于H2O,是因为它们都是极性分子
(2)与NH3互为等电子体的阳离子为 (写化学式)。
(3)1mol丙烯腈分子中含有![]() 键的数目为 。
键的数目为 。
(4)铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成。
①该反应的化学方程式为 。
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z同周期且相邻,第一电离能:Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)化合物XCl3的中心原子杂化类型为___________;RCl2的立体构型为___________;
(2)H2Z、H2R的沸点分别为100℃、-60.4℃,试解释其原因___________________;
(3)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,请根据结构与性质的关系解释K1>K2的原因___________________;
(4)Z、M形成的一种化合物晶胞如图所示:
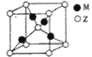
①该化合物的化学式为________________;
②若晶胞参数为apm.列式计算该晶胞的密度ρ=_____________gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
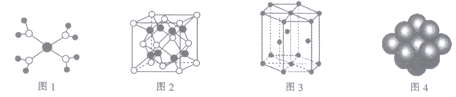
A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度和压强下,合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g);△H=-92.0KJ·mol-1将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,s反应达到平衡时的热量变化是
2NH3(g);△H=-92.0KJ·mol-1将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,s反应达到平衡时的热量变化是
A.吸收18.4KJ热量
B.放出18.4KJ热量
C.吸收73.6KJ热量
D.放出73.6KJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质量数为( )
A. 2(x-n) B. 2(x+n) C. 2x D. n+2x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下溶液:
①1.0mL0.10molL-1双氧水
②1.0mL0.20molL-1双氧水
③3.0mL0.10molL-1KMnO4溶液
④3.0mL0.010molL-1KMnO4溶液。
所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
(1)写出发生反应的离子方程式_________________________;若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4=K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为______________,若有9molH2O2参加该反应,则反应转移电子数目为___________;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂______进行实验(填序号)。
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为___________;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象。为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因___________;
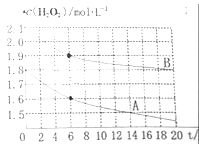
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则_____(填“A”或“B”)曲线所对应的实验温度高,判断的依据是___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com