
2013��12��2�գ��ҹ����������Ƿ��������á��������żס����ػ�������϶����š�̽�����dzɹ�����̫�գ���һ����㺮��̽�������������żס�������Һ�����ƻ����һ������Ϊ����ȼ�ϣ�����ȼ��ͨ��ָ���£�N2H4��Ϊȼ�ϣ��Զ�����������������
����ȼ��ͨ��ָ���£�N2H4��Ϊȼ�ϣ��Զ�������������������������Ϊ���÷��������������������������Ӧ�ͷŵ������������߷�Ӧ���ɵ����ͷ��������壩��
��֪��N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H = ��543kJ��mol��1
 H2(g)+
H2(g)+  F2(g)
= HF(g) ��H = ��269kJ��mol��1
F2(g)
= HF(g) ��H = ��269kJ��mol��1
H2(g)+  O2(g)
= H2O(g) ��H = ��242kJ��mol��1
O2(g)
= H2O(g) ��H = ��242kJ��mol��1
��д���ºͷ�����Ӧ���Ȼ�ѧ����ʽ��_____________________________��
��������������������NO�� O2���ɣ���֪��2 L�ܱ������ڣ�800 ��ʱ��Ӧ��
2NO(g)��O2(g) 2NO2(g)
��H ����ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)
��H ����ϵ�У�n(NO)��ʱ��ı仯�����
|
ʱ��(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
|
n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1) ��֪��K800��>K1000������÷�Ӧ�Ħ�H ______0������ڡ���С�ڡ�������O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������Ϊ__________��
��2)��˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a����������ɫ���ֲ��� b�� 2v��(NO)��v��(O2)
c��������ѹǿ���ֲ��� d���������ܶȱ��ֲ���
��3��Ϊʹ�÷�Ӧ�������������NO��ת���ʣ���ƽ��������Ӧ�����ƶ�Ӧ��ȡ�Ĵ�ʩ�� ��
��4�������������£�����ͨ��2 mol NO��1 mol O2��ƽ�ⳣ��K��______________��
��5�������������£�����ʼͨ�����0.2 mol NO2���壬�ﵽ��ѧƽ��ʱ����NO2��ת����Ϊ ��
��N2H4(g)+2F2(g)=N2(g)+4HF(g) ��H=��1135kJ��mol��1 ��2�֣�
��(1) С�ڣ�2�֣� ��0.015 mol��L��1��s��1 ��2�֣�
��2) a ��c����2�֣� ��3��ͨ������������ѹǿ��2�֣�
��4��720 ��2�֣� ��5��25%��2�֣�
��������
�������������N2H4��g��+O2��g��=N2��g��+2H2O��g������H=-543kJ•mol-1��
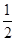 H2(g)+
H2(g)+ 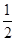 F2(g)
= HF(g) ��H = ��269kJ��mol��1��
F2(g)
= HF(g) ��H = ��269kJ��mol��1��
H2(g)+ 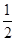 O2(g)
= H2O(g) ��H = ��242kJ��mol��1��
O2(g)
= H2O(g) ��H = ��242kJ��mol��1��
���ø�˹���ɿ�֪��+�ڡ�4-�ۡ�2�ɵ÷�ӦN2H4��g��+2F2��g��=N2��g��+4HF��g����
�÷�Ӧ�ġ�H=��-543kJ•mol-1��+4����-269kJ•mol-1��-2����-242kJ•mol-1��=-1135kJ•mol-1��
�ʴ�Ϊ��N2H4��g��+2F2��g��=N2��g��+4HF��g����H=-1135kJ•mol-1
��(1) ��ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ���ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ݴ���д��K800��>K1000����˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ��v(O2)=��0.100��0.040��mol/2L��2 s��0.015 mol��L��1��s��1
��2)a����������ɫ���ֲ��� ��˵������������Ũ�ȱ���һ����ֵ����Ӧ�ﵽƽ��״̬����ȷ��
B��2v��(NO)��v��(O2)��v(NO)��v(O2)�����ʱȲ����ڷ���ʽǰ���ϵ���������ж��Ƿ�ﵽƽ�⣬����
c����Ӧ������ѹǿ��С�ķ�Ӧ��ƽ��״̬������ѹǿ���ֲ��䣬˵����Ӧ�ﵽƽ�⣬��ȷ��
d������������������䣬�����������䣬�������Ƿ�ﵽƽ��״̬��������������ܶȱ��ֲ���������������ж��Ƿ�ﵽƽ�⣬����
��3��������������Է�Ӧ������ƽ����ƶ��������
��4��ƽ�ⳣ��K��ֻ���¶��йأ�����ͨ��2 mol NO��1 mol O2��ƽ�ⳣ��K�ͱ����е�ƽ�ⳣ����ͬ��
2NO(g) ��
O2(g) 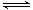 2NO2(g)
2NO2(g)
��ʼ��mol�� 0.200 0.100 0
�仯��mol�� 0.150 0.075 0.150
ƽ�⣨mol�� 0.050 0.025 0.150
Ũ�ȣ�mol/L�� 0.025 0.0125 0.0750
K��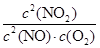 ��
��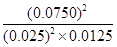 ��720
��720
��5�������������£�����ʼͨ�����0.2molNO2���壬�Ϳ�ʼͨ��0.200molNO��0.100molO2��Ч�����Դﵽƽ��״̬ʱNO2Ũ����0.0750mol/L����ʼŨ����0.100mol/L�����Է�Ӧ��0.0250mol/L����NO2ת������25%��
���㣺���黯ѧƽ�⣬��˹���ɡ�


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n��O2����mol�� | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �϶�����̽��������2013��12��2���賿1��30�����Ĵ�ʡ�������Ƿ�������ʹ�ó�����������ǿ�����ػ������ɹ��������һ�Ӽ��Ͷ��Ӽ�ʹ��ƫ�����º�N2O4��Ϊ�ƽ�������ӦʽΪ��CH3��2NNH2+2N2O4�T2CO2+4H2O+3N2�����Ӽ���ʹ��Ч�ܸ��ߵ�Һ�⣨H2����Һ����O2��������˵����ȷ���ǣ�������
�϶�����̽��������2013��12��2���賿1��30�����Ĵ�ʡ�������Ƿ�������ʹ�ó�����������ǿ�����ػ������ɹ��������һ�Ӽ��Ͷ��Ӽ�ʹ��ƫ�����º�N2O4��Ϊ�ƽ�������ӦʽΪ��CH3��2NNH2+2N2O4�T2CO2+4H2O+3N2�����Ӽ���ʹ��Ч�ܸ��ߵ�Һ�⣨H2����Һ����O2��������˵����ȷ���ǣ�������| A��N2O4�ڷ�Ӧ�б����� | B����CH3��2NNH2���л�ԭ�� | C����Ӧ��1mol N2O4�õ�4mol e- | D��Һ����Һ���ķ�Ӧ�У�Һ����Һ���������Ϊ 2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
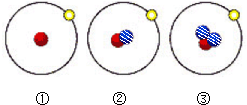 2013��12��2�ա��϶����š������״���������½����Я���ĺ��ܵ���ֳƷ�����ͬλ�ط���װ�ã������йؼ�ԭ�ӵ�ԭ�ӽṹ�٢ڢ۵�������ȷ���ǣ�������������
2013��12��2�ա��϶����š������״���������½����Я���ĺ��ܵ���ֳƷ�����ͬλ�ط���װ�ã������йؼ�ԭ�ӵ�ԭ�ӽṹ�٢ڢ۵�������ȷ���ǣ������������� ��ʾ���ӣ�
��ʾ���ӣ� ��ʾ���ӣ�
��ʾ���ӣ� ��ʾ���ӣ�
��ʾ���ӣ�| A���٢ڢ۶��������ӡ����ӡ�������ɵ� | B���٢ڢ۶�Ϊ��Ԫ�ص�һ�ֺ��� | C���٢ڢ۾�����ͬ�������� | D���٢ڢ������ֻ�ѧ������ȫ��ͬ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�갲��ʡ��У�о������������1�£����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
2013��12��2��1ʱ30��,�������϶������ij������������ػ������������������������������ȷ���,����Բ���ɹ��������һ�Ӽ����������Ͷ��Ӽ�ʹ��ƫ������[(CH3)2NNH2���ṹ��ͼ��ʾ]��N2O4��Ϊ�ƽ���, ��Ӧ���£�(CH3)2NNH2 + 2N2O4��2CO2��+ 4H2O��+ 3N2���������й�˵����ȷ����
A����NAΪ����٤��������ֵ����46g NO2��N2O4�Ļ�����庬�е���ԭ������2NA��4NA֮��
B��ƫ�����·����мȺ������ֺ�����
C��(CH3)2NNH2��N2O4�����ڷ��Ӿ���
D��ÿ��Ӧ1mol(CH3)2NNH2��44.8L N2O4����ԭ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com