
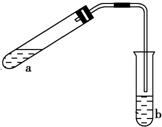
 ������ͼ��ʾ��װ����ȡ���������������ƾ��Ƶ���ͼ�о�����ȥ��������գ�
������ͼ��ʾ��װ����ȡ���������������ƾ��Ƶ���ͼ�о�����ȥ��������գ����� ��1�����ʱ�ȼ��Ҵ������Ũ���ᣬ�������ᣬ�������������ʣ�
��2��Һ����ʵ��ʱ�������У��ɼӷ�ʯ�������Ƭ����
��3�����ᡢ�Ҵ�������ˮ�����ܿ���Һ���¿ɷ���������
��4������̼������Һ�������Ҵ�����ȥ���ᣬ���������������ܽ�ȣ�
��5����Ӧ���������Թ�b�����ã�����������̼������Һ�ֲ㣬�������������ܶȱ�ˮ���ܶ�С��
��� �⣺��1���Թ�a����Ҫ����Ũ���ᡢ��������Ҵ���2mL����ȷ�ļ���˳�������ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ����ټ�������ᣬ
�ʴ�Ϊ���ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ����ټ�������
��2��Ϊ��ֹa�е�Һ����ʵ��ʱ�������У��ڼ���ǰӦ��ȡ�Ĵ�ʩ�����Թ�a�м��뼸����ʯ�������Ƭ����
�ʴ�Ϊ�����Թ�a�м��뼸����ʯ�������Ƭ����
��3�����ܲ�������bҺ���µ�ԭ���Ƿ�ֹ������
�ʴ�Ϊ����ֹ������
��4���Թ�b�м��б���Na2CO3��Һ���������������Ҵ�����ȥ���ᡢ���������������ܽ�ȣ�
�ʴ�Ϊ�������Ҵ�����ȥ���ᡢ���������������ܽ�ȣ�
��5����Ӧ���������Թ�b�����ã��۲쵽��������b�е�Һ��ֲ㣬�ϲ���������״Һ�壬
�ʴ�Ϊ��b�е�Һ��ֲ㣬�ϲ���������״Һ�壮
���� ���⿼���л�����Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ʵ����������������ᴿ���л��������Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��ʵ�鰲ȫ�ķ�������Ŀ�ѶȲ���


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʢŨ����ķ�Һ©�����ó���©������ | |
| B�� | ���ڼ���ƿ�ڷ�һ��ʪ��ĵ��۵⻯����ֽ���۲������Ƿ��ռ��� | |
| C�� | �ñ���ʳ��ˮ����β�� | |
| D�� | Ϊ�˱���ѧ���۲��������Ʊ�ʵ�飬���ڽ�̨��ֱ�����������Ʊ�ʵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +CaCl2+H2O���÷�Ӧ��ԭ��������25.4%��
+CaCl2+H2O���÷�Ӧ��ԭ��������25.4%�� ��
�� �����Ҷ������ã�������һϵ�л����
�����Ҷ������ã�������һϵ�л����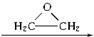 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
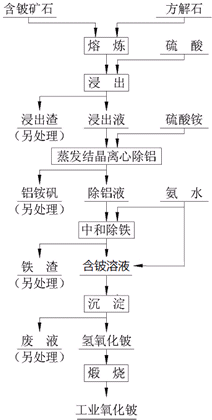 ���ᷨ���ִ���������������������й㷺Ӧ�õķ���֮һ����ԭ��������Ԥ�����ƻ���������ʯ-3BeO•Al2O3•6SiO2������FeO�ȣ��Ľṹ�뾧�ͣ��ٲ���������⺬����ʹ�롢�������������Խ���������Һ�࣬������ʯ����������룬Ȼ������Һ���о��������ӣ����յõ��ϸ�������루 ���������룩 ��Ʒ���乤��������ͼ��
���ᷨ���ִ���������������������й㷺Ӧ�õķ���֮һ����ԭ��������Ԥ�����ƻ���������ʯ-3BeO•Al2O3•6SiO2������FeO�ȣ��Ľṹ�뾧�ͣ��ٲ���������⺬����ʹ�롢�������������Խ���������Һ�࣬������ʯ����������룬Ȼ������Һ���о��������ӣ����յõ��ϸ�������루 ���������룩 ��Ʒ���乤��������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com