
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
分析 烃在光照下与氯气反应,只生成一种一氯代物,说明该烃分子中氢原子只有一种,据此进行判断.
解答 解:A.2-甲基丙烷的结构简式为:CH3CH(CH3)CH3,其分子中有2种等效氢原子,其一氯代物有2种,故A错误;
B.异戊烷的结构简式为:CH3CH2CH(CH3)2,其分子中含有4种等效氢原子,其一氯代物有4种,故B错误;
C.2,2-二甲基丙烷的结构简式为:CH3C(CH3)2CH3,其分子中所有H原子都完全等效,则其一氯代物只有1种,故C正确;
D.2,2-二甲基丁烷的结构简式为:CH3C(CH3)2CH2CH3,其分子中含有3种等效氢原子,其一氯代物有3种,故D错误
故选C.
点评 本题考查了同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,明确烃中等效氢原子数目的求算方法为解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ | |
| C. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 硫化钠溶液显碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
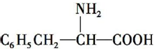 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “若水银已升朱”指的是水银气化,属于物理变化 | |
| B. | 朱砂、水银、银朱中均含汞元素,其组成、结构或纯度有所不同 | |
| C. | 常温下,朱砂转化为水银是不自发的过程 | |
| D. | 工业废水中含有汞离子,可以加入FeS固体除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com