
【题目】下列叙述中不正确的是( )(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.l mol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3 mol/L的KCl和K2CrO4混合液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-) = c(CH3COOH)+c(H+)
【答案】D
【解析】
A选项,根据物料守恒,0.l mol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O) = c(HS-)+c(S2-) +c(H2S),因此有c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-),故A正确;
B选项,AgCl饱和溶液中c(Cl-)=![]() mol/L=2×10-5mol/L,AgBr饱和溶液中c(Br-)=
mol/L=2×10-5mol/L,AgBr饱和溶液中c(Br-)=![]() mol/L=7×10-7mol/L,AgCl饱和溶液中Cl-浓度远大于AgBr饱和溶液中Br-浓度,将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,则原溶液中的氯离子和溴离子沉淀,AgCl物质的量远远大于AgBr,因此AgCl沉淀质量大于AgBr沉淀,故B正确;
mol/L=7×10-7mol/L,AgCl饱和溶液中Cl-浓度远大于AgBr饱和溶液中Br-浓度,将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,则原溶液中的氯离子和溴离子沉淀,AgCl物质的量远远大于AgBr,因此AgCl沉淀质量大于AgBr沉淀,故B正确;
C选项,浓度均为1×10-3 mol/L的KCl和K2CrO4混合液中,氯离子沉淀需要的银离子浓度为![]() mol/L,CrO42-沉淀需要的银离子浓度为
mol/L,CrO42-沉淀需要的银离子浓度为![]() mol/L=
mol/L=![]() ×10-5mol/L>4×10-7mol/L,向混和溶液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀,故C正确;
×10-5mol/L>4×10-7mol/L,向混和溶液中滴加1×10-3 mol/L AgNO3溶液,先生成AgCl沉淀,故C正确;
D选项,常温下,pH=4.75浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液,根据电荷守恒得到c(CH3COO-)+c(OH-) = c(Na+)+c(H+),根据物料守恒得到c(CH3COO-)+c(CH3COOH) =2c(Na+),因此得到c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+),故D错误;
综上所述,答案为D。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是
等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积变化如图所示。下列说法正确的是![]()
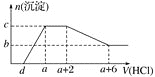
A.原溶液中可能含有![]() 、可能不含有
、可能不含有![]()
B.原溶液中一定含有的阴离子只有:![]() 、
、![]() 、
、![]()
C.原溶液中含![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图:
![]()
下列关于该有机物的说法正确的是( )
①分子式为C16H14O5;
②能使酸性KMnO4溶液褪色;
③能发生加成反应和取代反应;
④苯环上的一溴代物有4种;
⑤1 mol该有机物水解时最多能消耗4 mol NaOH;
⑥1 mol该有机物在一定条件下和H2反应,共消耗6 mol H2。
A.①②⑤B.①②③⑤⑥C.①④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种无机物具有如图所示的转化关系(反应条件及反应中的水均略去),且A、B、C含有同一种元素。下列说法错误的是
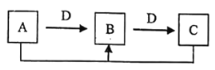
A.若A的溶液显碱性,则D可能是单质
B.A与C的反应可能是非氧化还原反应
C.A或D可能是目前使用最广泛的金属单质
D.若C是能使澄清石灰水变浑浊的气体,则A一定是单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. C2H6和C4H10一定是同系物B. C2H4和C4H8一定都能使溴水退色
C. C3H6不只表示一种物质D. 烯烃中各同系物中碳的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,反应:A(g)+B(g) ![]() C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
A.A的浓度一定比原平衡小
B.A的转化率增大
C.C的体积分数一定大于原平衡C的体积分数
D.B的转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com