
| ½šŹōĄė×Ó | æŖŹ¼³ĮµķŹ±µÄpH | ³ĮµķĶźČ«µÄpH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |

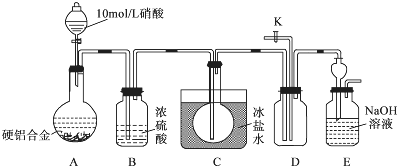
·ÖĪö £Ø1£©¢ŁĶÓėĻ”ĻõĖį·“Ӧɜ³ÉĻõĖįĶ”¢Ņ»Ńõ»ÆµŖĘųĢåŗĶĖ®£»
¢Śøł¾Ż”°³£ĪĀĻĀ£¬NO2ÓėN2O4»ģŗĻ“ęŌŚ£¬ŌŚµĶÓŚ0”ꏱ¼øŗõÖ»ÓŠĪŽÉ«µÄN2O4ŅŗĢå»ņ¾§Ģå“ęŌŚ”±¼°ŹµŃéÄæµÄ·ÖĪö£»
¢Ū¶žŃõ»ÆµŖĪŖŗģ×ŲÉ«ĘųĢ壬æÉŅŌøł¾ŻAÖŠÉś³ÉĘųĢåŃÕÉ«¼°CÖŠŹĒ·ńÓŠ¹ĢĢåÉś³ÉÅŠ¶Ļ£»DÖŠĶØČėŃõĘų£¬ĪŽÉ«ĘųĢå±äĪŖŗģ×ŲÉ«æÉŅŌÖ¤Ć÷Éś³ÉµÄĘųĢåÖŠŗ¬ÓŠNO£»
¢ÜNOÄܹ»ÓėæÕĘųÖŠŃõĘų·“Ӧɜ³É¶žŃõ»ÆµŖ£¬Ó°ĻģµÄŹµŃé²ā¶Ø£»
£Ø2£©¢Łøł¾Ż·“Ó¦Į÷³ĢæÉÖŖ£¬ČÜŅŗBÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£¬³ĮµķCĪŖĒāŃõ»ÆĆ¾”¢ĒāŃõ»ÆĶ£¬ĖłŅŌµ÷½ŚµÄČÜŅŗµÄpH±ŲŠėŹ¹ĒāŃõ»ÆĀĮĶźČ«Čܽā£»
¢ŚČÜŅŗBÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£¬·¢Éś·“Ó¦ĪŖĀĮĄė×ÓÓėĒāŃõøłĄė×Ó·“Ӧɜ³ÉĘ«ĀĮĖįøłĄė×ÓŗĶĖ®£»
¢ŪĒāŃõ»ÆĀĮ×ĘÉÕÉś³ÉŃõ»ÆĀĮ£¬øł¾ŻŃõ»ÆĀĮµÄÖŹĮæ¼ĘĖć³öĀĮĄė×ÓµÄĪļÖŹµÄĮ棬ŌŁ¼ĘĖć³öŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹż£®
½ā“š ½ā£ŗ£Ø1£©¢ŁĶÓėĻ”ĻõĖį·“Ӧɜ³ÉNOĘųĢ壬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ3Cu+2NO3-+8H+=3Cu2++2NO”ü+4H2O£¬
¹Ź“š°øĪŖ£ŗ3Cu+2NO3-+8H+=3Cu2++2NO”ü+4H2O£»
¢ŚŅŃÖŖ³£ĪĀĻĀ£¬NO2ÓėN2O4»ģŗĻ“ęŌŚ£¬ŌŚµĶÓŚ0”ꏱ¼øŗõÖ»ÓŠĪŽÉ«µÄN2O4ŅŗĢå»ņ¾§Ģå“ęŌŚ£¬¶ųŹµŃéÄæµÄŹĒ¼ģŃéÉś³ÉµÄĘųĢåÖŠŗ¬ÓŠNO£¬ĖłŅŌ×°ÖĆCµÄ×÷ÓĆŹĒ½«Éś³ÉµÄNO2ĄäÄżĪŖN2O4£¬ÓėNO·ÖĄė£¬ÅųżøÉČÅ£¬
¹Ź“š°øĪŖ£ŗ½«Éś³ÉµÄNO2ĄäÄżĪŖN2O4£¬ÓėNO·ÖĄė£¬ÅųżøÉČÅ£»
¢ŪČōAÖŠÓŠŗģ×ŲÉ«µÄĘųĢåÉś³É£¬CÖŠÓŠĪŽÉ«µÄŅŗĢå»ņ¾§Ģå“ęŌŚ£¬ŌņÖ¤Ć÷·“Ó¦ÖŠÓŠ¶žŃõ»ÆµŖĘųĢåÉś³É£»ÄÜÖ¤Ć÷ÓŠNOÉś³ÉµÄŹµŃé²Ł×÷ÓėĻÖĻóĪŖ£ŗ“ņæŖ»īČūK£¬¹ÄČėæÕĘų£¬ČōDÖŠµÄĘųĢåÓÉĪŽÉ«±äĪŖŗģ×ŲÉ«£¬Ö¤Ć÷ÓŠNOÉś³É£¬
¹Ź“š°øĪŖ£ŗ“ņæŖ»īČūK£¬¹ÄČėæÕĘų£¬ČōDÖŠµÄĘųĢåÓÉĪŽÉ«±äĪŖŗģ×ŲÉ«£¬Ö¤Ć÷ÓŠNOÉś³É£»
¢ÜÓÉӌװÖĆÖŠŃõĘųÓėNO·“Ӧɜ³É¶žŃõ»ÆµŖ£¬øÉČÅĮĖŹµŃ飬ĖłŅŌÓ¦øĆ¼ÓČėHNO3Ē°£¬ĶØČėN2£¬³ż¾”×°ÖĆÖŠµÄæÕĘų£¬
¹Ź“š°øĪŖ£ŗŌŚ¼ÓČėHNO3Ē°£¬ĶØČėN2£¬³ż¾”×°ÖĆÖŠµÄæÕĘų£»
£Ø2£©¢Ł½įŗĻ·“Ó¦Į÷³ĢæÉÖŖ£¬ČÜŅŗBÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£¬³ĮµķCĪŖĒāŃõ»ÆĆ¾”¢ĒāŃõ»ÆĶ£¬Ōņµ÷½ŚČÜŅŗµÄpH±ŲŠėĀś×ć£¬Ć¾Ąė×Ó”¢ĶĄė×ÓĶźČ«³Įµķ£¬¶ųĀĮĄė×ÓĶźČ«×Ŗ»Æ³ÉĘ«ĀĮĖįøłĄė×Ó£¬øł¾Ż±ķÖŠŹż¾Ż¼°ĒāŃõ»ÆĀĮĶźČ«ČܽāµÄpHæÉÖŖ£¬“ĖŹ±µÄpHpH”Ż12.4£¬
¹Ź“š°øĪŖ£ŗpH”Ż12.4£»
¢ŚČÜŅŗBÖŠŗ¬ÓŠĘ«ĀĮĖįøłĄė×Ó£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl3++4OH-=AlO2-+2H2O£¬
¹Ź“š°øĪŖ£ŗAl3++4OH-=AlO2-+2H2O£»
¢Ū8.5gĪŖŃõ»ÆĀĮµÄÖŹĮ棬ŌņŃõ»ÆĀĮµÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{8.5g}{102g/mol}$”Ö0.0833mol£¬øł¾ŻÖŹĮæŹŲŗćæÉÖŖŗĻ½šÖŠŗ¬ÓŠĀĮµÄĪļÖŹµÄĮæĪŖ£ŗ0.0833mol”Į2=0.1666mol£¬ĖłŅŌŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹżĪŖ£ŗ$\frac{27g/mo”Į0.1666mol}{5g}$”Į100%”Ö90.0%£¬
¹Ź“š°øĪŖ£ŗ90.0%£®
µćĘĄ ±¾Ģāæ¼²éĮĖĢ½¾æĪļÖŹ×é³É”¢²āĮæĪļÖŹŗ¬ĮæµÄ·½·Ø£¬ĢāÄæÄŃ¶Č½Ļ“ó£¬ŹŌĢāÖŖŹ¶µć½Ļ¶ą”¢×ŪŗĻŠŌ½ĻĒ棬³ä·Öæ¼²éĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°»Æѧ¼ĘĖćÄÜĮ¦£¬Ć÷Č·²ā¶ØŌĄķĪŖ½ā“š¹Ų¼ü£¬×¢ŅāŹģĮ·ÕĘĪÕ»ÆѧŹµŃ黳±¾²Ł×÷·½·Ø£®


 ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū | B£® | ¢Ś¢Ū¢Ü | C£® | ¢Ł¢Ś¢Ü | D£® | ¢Ł¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠĪ³ÉĖįÓź | B£® | Ź¹Č«ĒņĘųŗņ±äÅÆ | C£® | ĘĘ»µ³ōŃõ²ć | D£® | ²śÉśĄ×µē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬11.2 L CCl4Ėłŗ¬µÄ·Ö×ÓŹżĪŖ0.5 NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬4.2 g C2H4ŗĶC8H16µÄ»ģŗĻĪļÖŠŗ¬ÓŠµÄĢ¼Ō×ÓŹżĪŖ0.3 NA | |
| C£® | 7.8 g±½·Ö×ÓÖŠĢ¼Ģ¼Ė«¼üµÄŹżÄæĪŖ0.3 NA | |
| D£® | 6.4 g CuÓė20 mL 10 mol•L-1ÅØĮņĖį·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ0.2 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ö²ŹĒŅ»ÖÖ·ÖÉ¢Ļµ£¬·ÖÉ¢ÖŹŹĒ¹ĢĢå | |
| B£® | ĪķŹĒŅ»ÖÖ·ÖÉ¢Ļµ£¬·ÖÉ¢¼ĮŹĒĘųĢå | |
| C£® | ö²ŹōÓŚ½ŗĢå·ÖÉ¢Ļµ | |
| D£® | ¼õÉŁÉś²śÉś»īÖŠ²śÉśµÄŃļ³¾æÉŅŌ¼õÉŁĪķö²ĢģĘųµÄŠĪ³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬Ēė»Ų“šĻĀĮŠĪŹĢā
¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬Ēė»Ų“šĻĀĮŠĪŹĢā²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČĪŗĪĖįÓė¼ī·“Ӧɜ³É1 mol H2OµÄ¹ż³ĢÖŠ£¬·Å³öµÄČČĮæ¾łĻąĶ¬ | |
| B£® | µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬Ē°Õ߷ųöČČĮæ¶ą | |
| C£® | ¹āÕÕŹ±£¬H2£Øg£©+Cl2£Øg£©ØT2HCl£Øg£©”÷H=aKJ/mol£»Čō·“Ó¦Ģõ¼ž±äĪŖµćČ¼£¬”÷H½«¼õÉŁ | |
| D£® | ±ķŹ¾Ģ¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2C£Øs£©+O2£Øg£©ØT2CO£Øg£©”÷H=-221kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com